
【题目】在给定条件下,下列选项所示的物质间的转化均能实现的是
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2(aq) ![]()
C.MgCl2﹒6H2O(s) ![]()
D.CH3CH2CH2CH2Br![]() CH3CH2CH=CH2
CH3CH2CH=CH2![]()
![]()
![]() CH2=CH-CH=CH2
CH2=CH-CH=CH2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2。某校化学研究小组利用下图实验装置检验产物中的H2和CO(设气体均被充分吸收)。下列有关说法正确的是

A. ②、③、⑤中依次盛装澄清石灰水、浓硫酸和氢氧化钠溶液
B. 为了实验安全性,应先点燃①处酒精灯,后点燃④处酒精灯
C. 当黑色氧化铜变红色,即可证明产物中一定含有H2 和CO
D. 若用碱石灰替换无水硫酸铜,也可达到检验H2 和CO目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C.无色透明的溶液中: Fe3+、Al3+、NO3-、SO42-
D.![]() =1012的溶液中:Na+、Ba2+、Cl-、AlO2-
=1012的溶液中:Na+、Ba2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如图所示。甲与戊的原子序数相差3,戊是空气中含量最多的元素,丁与辛是同周期元素。下列说法正确的是( )
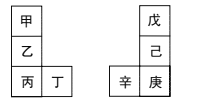
A.丙不能与水发生反应
B.己和氯气反应的产物只有一种
C.丙与庚的原子核外电子数相差13
D.乙形成的氧化膜疏松,不能保护内层金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示实验装置探究铜丝与过量浓硫酸的反应。
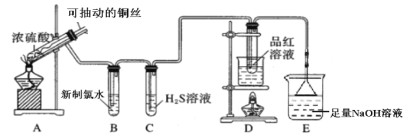
(1)写出A中发生反应的化学方程式__________。在此反应中,浓硫酸表现出来的性质有__________。(填字母序号)
A.强氧化性 B.酸性 C.吸水性 D.脱水性
(2)一段时间后,观察到B中溶液黄绿色褪去,B中反应的化学方程式为__________。C中的实验现象为__________。
(3)D中的实验现象是__________,一段时间后,点燃D处酒精灯,可以观察到__________。
(4)E装置中NaOH溶液的作用是__________。
(5)研究小组认为可以用H2O2溶液来验证E中溶液含有SO32-,进行了实验i。
实验序号 | 操作 | 现象 |
i | a. 取少量E中溶液,向其中加入适量H2O2溶液,振荡,观察。 | 无明显现象 |
b. 然后滴加__________,振荡,观察。 | 无明显现象 | |
c. 再滴加__________,振荡,观察。 | 白色沉淀 |
通过实验i可证明E中溶液含有SO32-,写出操作b、c中滴加的试剂是__________、__________。
(6)研究小组反思实验方案i不够严谨,设计了对比实验,证明了E中含有SO32-。该对比实验方案是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.已知2C(s)+2O2(g)=2CO2(g)△H=a kJmol-1,2C(s)+O2(g)=2CO(g)△H=b kJmol-1,则a>b
B.石墨和金刚石完全燃烧的化学方程式均可表示为“C+O2![]() CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,据此实验事实可知:该条件下,每生成1mol NH3,放热19.3 kJ
D.4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)是放热反应,Cl-Cl键和O=O键的键能分别243kJmol-1和498kkJmol-1,则可推算出H-O键的键能比H-Cl键的键能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A. 增大c(A)、c(B),K增大
B. 降低温度,正反应速率增大
C. 该反应的焓变为负值
D. 该反应的化学方程式为2E(g)+F(g)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6=3Na++AlF63-。现有冰晶石的结构单元如图所示,![]() 位于大立方体顶点和面心,
位于大立方体顶点和面心,![]() 位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中
位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中![]() 、
、![]() 中的一种。下列说法正确的是( )
中的一种。下列说法正确的是( )
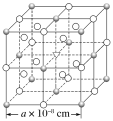
A.冰晶石是原子晶体
B.大立方体的体心处▽代表Al3+
C.与Na+距离相等且最近的Na+有6个
D.冰晶石晶体的密度为![]() ×1024g·cm-3
×1024g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
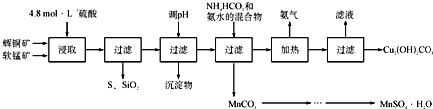
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0molL-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
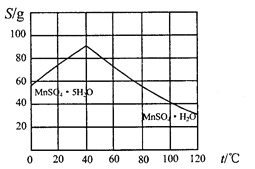
(6)用标准BaCl2溶液测定样品中MnSO4H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com