
 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如图:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如图: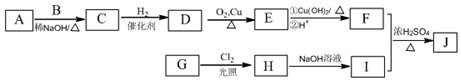
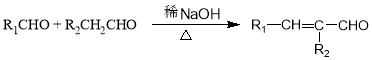
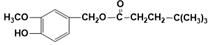 .
.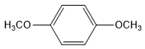 (写结构简式).
(写结构简式). 分析 D氧化得到E、E氧化得到F,则D中存在-CH2OH结构,E含有-CHO,F含有-COOH,F与I反应得到J,J的分子式为C15H22O4,结合J的结构特点,可知F为C6H13COOH.A、B和E为同系物,其中B的相对分子质量为44,则B为CH3CHO,A分子中碳原子数目为5,A的核磁共振氢谱显示有两组峰,则A为(CH3)3CCHO,根据信息③可知,A与B反应得到C,C与氢气反应得到D,则C为(CH3)3CCH=CHCHO,D为(CH3)3CCH2CH2CH2OH,E为(CH3)3CCH2CH2CHO,F为(CH3)3CCH2CH2COOH.G与氯气光照发生侧链烃基上取代反应生成H,H发生卤代烃水解反应得到I,则可知I为 ,G为
,G为 ,H为
,H为 ,F和I发生酯化反应生成J为
,F和I发生酯化反应生成J为 ,以此解答该题.
,以此解答该题.
解答 解:(1)G为 ,所含官能团的名称为羟基、醚键,
,所含官能团的名称为羟基、醚键,
故答案为:羟基、醚键;
(2)C生成D的反应类型为加成反应,D为(CH3)3CCH2CH2CH2OH,名称为:4,4-二甲基-1-戊醇,
故答案为:加成反应;4,4-二甲基-1-戊醇;
(3)E为(CH3)3CCH2CH2CHO,与氢氧化铜浊液发生氧化还原反应,方程式为(CH3)3CCH2CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$( CH3)3CCH2COONa+Cu2O↓+3H2O,
故答案为:(CH3)3CCH2CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$( CH3)3CCH2COONa+Cu2O↓+3H2O;
(4)由以上分析可知J为 ,故答案为:
,故答案为: ;
;
(5)G( )的同分异构体中,苯环上的一氯代物只有一种,可以含有2个-CH2OH且处于对位,或含有2个-OCH3且处于对位,可以含有4个取代基,为2个-OH、2个-CH3,当2个甲基相邻时,另外2个-OH分别与甲基相邻,或分别与甲基处于间位,当2个甲基处于间位时,另外2个-OH处于对位且分别与甲基相邻、相间,当2个甲基对位时,2个-OH分别与2个甲基相邻且2个羟基处于对位,或者2个羟基处于对位,或者2个-OH分别与1个甲基相邻,故符合条件的同分异构共有8种,核磁共振氢谱显示2组峰的是
)的同分异构体中,苯环上的一氯代物只有一种,可以含有2个-CH2OH且处于对位,或含有2个-OCH3且处于对位,可以含有4个取代基,为2个-OH、2个-CH3,当2个甲基相邻时,另外2个-OH分别与甲基相邻,或分别与甲基处于间位,当2个甲基处于间位时,另外2个-OH处于对位且分别与甲基相邻、相间,当2个甲基对位时,2个-OH分别与2个甲基相邻且2个羟基处于对位,或者2个羟基处于对位,或者2个-OH分别与1个甲基相邻,故符合条件的同分异构共有8种,核磁共振氢谱显示2组峰的是 ,
,
故答案为:8; .
.
点评 本题考查有机物推断与合成,为高频考点,题目充分利用反应条件、J的结构特点与分子式进行推断,需要学生熟练掌握官能团的性质与转化,侧重考查学生分析推理能力,难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L Na2 SO4 | B. | 150ml 1.5mol/LKAl (SO4)2 | ||
| C. | 500ml 0.3mol/L Fe SO4 | D. | 50ml 3mol/L Fe2 (SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
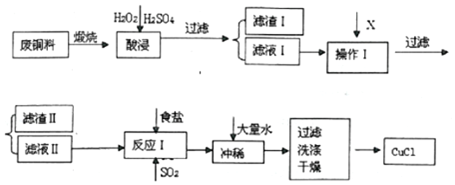
| 物质 | 开始沉淀pH | 沉淀完全pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.75 | 24.85 | 24.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 铝箔在酒精灯上加热,熔化后的液态铝不滴落 | 高熔点的氧化铝薄膜兜在铝的外面,阻止了液态铝滴落 |
| B | 铁放在冷的浓硝酸中不溶解,无红棕色气体生成 | 铁遇浓硝酸钝化,表面形成致密的氧化膜,阻止内部铁继续与硝酸反应 |
| C | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| D | 将新制氯水滴到蓝色石蕊试纸上,试纸先变红后褪色 | 新制氯水中的H+使石蕊试纸先变红,HClO的强氧化性使石蕊试纸褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl的分子所含中子数约为6.02×1023 | |
| C. | 3.5Cl2气体的体积约为22.4L | |
| D. | 35Cl2气体的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
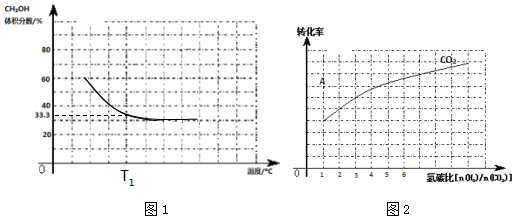
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中膜为阴膜(只允许阴离子通过),OH-从右往左通过该膜 | |
| B. | 电解时,阴极电极反应式为:2H++2e-═H2↑ | |
| C. | 电解时,如有3mol电子通过导线,则一定生成0.6mol KIO3 | |
| D. | 电池总反应为:KI+3H2O $\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫和氯气都能使品红溶液褪色 | |
| B. | 漂白粉暴露在空气中久置会变质 | |
| C. | 在加热条件下,镁能在二氧化碳气体中燃烧 | |
| D. | 氯水中真正起漂白、杀菌、消毒作用的微粒是其中含有的Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐中加有碘,用其配成的溶液遇淀粉变蓝 | |
| B. | 厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大 | |
| C. | 使用氯气自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害 | |
| D. | 硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com