
| A. | 37.6% | B. | 36.8% | C. | 25.6% | D. | 51.2% |
分析 根据所给物质的化学式进行分析,可以发现,在这三种物质中,钠元素与硫元素的原子个数比为2:1,也就是钠元素和硫元素的质量比是定值46:32,根据硫元素的质量分数为25.6%计算钠元素的质量分数,氧元素的质量分数为1-ω(Na)-ω(S),从而确定氧元素的质量分数.
解答 解:在这三种物质中,钠元素与硫元素的原子个数比为2:1,也就是钠元素和硫元素的质量比是定值为46:32,硫元素的质量分数为25.6%,所以钠元素的质量分数是25.6%×$\frac{46}{32}$=36.8%,故氧元素的质量分数为:1-25.6%-36.8%=37.6%.
故选:A.
点评 本题考查了混合物的计算、质量分数计算等,难度中等,根据化学式判断物质中Na、S元素的质量比是解题的关键.


科目:高中化学 来源: 题型:填空题
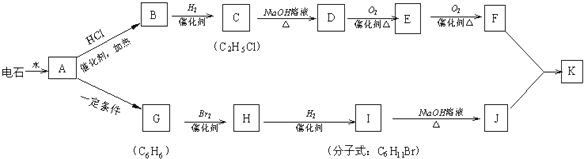
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3 NA | |
| B. | 1 2.5 mL1 6 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2 NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中含有的阴离子数等于0.1 NA | |
| D. | 0.5 mol氧单质含有NA个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、Cl-,可能有NH4+ | |
| B. | 肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- | |
| C. | 肯定有K+、Al3+、MnO4-,可能有HCO3- | |
| D. | 肯定有Al3+、Mg2+、Cl-,可能有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 在使用过程中,电子由Ag2O经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn极发生还原反应,Ag2O极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少含有4种离子 | |
| B. | 取少量原溶液先加入盐酸,后加入BaCl2溶液,肯定会产生白色沉淀 | |
| C. | 若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则可推断溶液中含有K+ | |
| D. | 溶液中可能含有Fe3+、NH4+、SO42-、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com