
| A、2Q2=Q1<Q |
| B、2Q2<Q1=Q |
| C、2Q2<Q1<Q |
| D、Q1=2Q2=Q |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用热的纯碱溶液清除灶具上的油污 |
| B、用硫酸清洗锅炉中的水垢 |
| C、用明矾[KAl(SO4)2.12H2O]作净水剂,除去水中悬浮的杂质 |
| D、用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 表示的粒子不会对水的电离平衡产生影响 表示的粒子不会对水的电离平衡产生影响 |
B、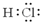 表示的物质加入水中,促进水的电离,c(H+)增大 表示的物质加入水中,促进水的电离,c(H+)增大 |
C、25℃时,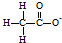 表示的微粒加入水中,促进水的电离,Kw不变 表示的微粒加入水中,促进水的电离,Kw不变 |
| D、水的电离程度只与温度有关,温度越高,电离程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.40 mol |
| B、大于0.80 mol |
| C、等于0.80 mol |
| D、大于0.40 mol,小于0.80 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用简易量热计能粗略测量稀盐酸和烧碱稀溶液中和反应的反应热 |
| B、pH<7的溶液不可能呈中性 |
| C、所有化学反应的反应热均可通过实验直接测定 |
| D、铅酸蓄电池充电和放电时的所发生的反应互为可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3+H2SO4═Na2SO4+CO2↑+H2O |
| B、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| C、KHCO3+HCl═KCl+CO2↑+H2O |
| D、BaCO3+2HNO3═Ba(NO3 )2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com