
I、合成氨对农业生产及国防建设均具有重要意义。
(1)在恒温恒容密闭容器中进行的合成氨反应,N2(g)+3H2(g) ![]() 2NH3(g),下列能表示达到平衡状态的是_______(填序号)。
2NH3(g),下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
II、能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
(1)将1.0molCH4和2.0molH2O(g)通入容积为10 L的反应室,在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如下图。
CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如下图。

①假设100℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 ;
②100℃时反应的平衡常数为 。
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH (g)生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
CH3OH (g)生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减小 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH3OH)减小
E.平衡常数K增大
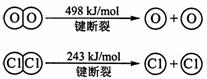
(3)已知: 反应:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH= —116 kJ/mol
2Cl2(g)+2H2O(g) ΔH= —116 kJ/mol
H2(g) + Cl2(g) == 2HCl(g) ΔH= —184 kJ/mol
Ⅱ ![]()
![]()
请回答:
①H2与O2反应生成气态水的热化学方程式是____ ___。
②断开1 mol H—O 键所需能量约为______kJ。
科目:高中化学 来源:0101 期中题 题型:填空题
 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com