
【题目】利用下列实验装置进行的相应实验,不能达到实验目的是( ) 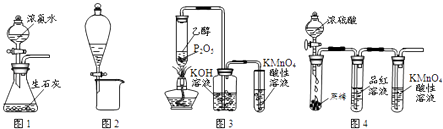
A.用图1所示装置可制取氨气
B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.用图3所示装置可制取乙烯并验证其易被氧化
D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
【答案】B
【解析】解:A.浓氨水与生石灰制取氨气,选固体与液体反应不需要加热装置,则图中装置能实现氨气的制取,故A正确; B.CH3CH2OH和CH3COOC2H5不分层,则不能利用图中分液装置操作,故B错误;
C.乙醇挥发后溶解在KOH溶液中,排除对乙烯检验的干扰,则图中装置能制取乙烯并验证其易被氧化,故C正确;
D.浓硫酸使蔗糖变黑,体现脱水性,与C反应生成二氧化硫,体现其强氧化性,图中品红褪色,说明二氧化硫具有漂白性,高锰酸钾溶液褪色,发生氧化还原反应,说明二氧化硫具有还原性,所以图中装置能说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性,故D正确;
故选B.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为W,物质的量浓度为cmol/L,则下列关系中不正确的是( )
A.W= ![]()
B.W= ![]()
C.ρ= ![]()
D.c= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( ) 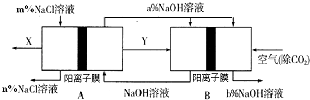
A.X为H2 , Y为Cl2
B.A池为电解池,且m<n
C.B池为燃料电池,且a>b
D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种化合物,各取40g相混合,完全反应后,得18g B、49g C,还有D生成.已知D的相对分子质量为106.现将80g A和33g B反应,能生成D( )
A.1 mol
B.0.5 mol
C.0.75 mol
D.0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质发生化学变化不一定都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.即使没有物质的变化,也可能有能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的容器中加入1.5 mol氙气(Xe)和7.5 mol氟气(F2),于400 ℃和2633 kPa压强下加热数小时,然后迅速冷却至25 ℃,容器内除得到一种无色晶体外,还有4.5 mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是( )
A. 1∶2 B. 1∶3 C. 1∶4 D. 1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉. Ⅰ.废液组成:
金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
浓度(gL﹣1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
Ⅱ.处理方案:
(1)步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2. 此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是 .
(2)步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤. ①Mn2+反应生成MnO2同时放出CO2 , 写出此反应的离子方程式: .
②Co2+反应生成Co(OH)3沉淀同时放出CO2 , 写出此反应的离子方程式:;
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式: .
③此步骤中必须控制好NaClO溶液的用量,其原因可能是 .
(3)步骤3:回收镍 以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍
粉.电解过程中电流效率与pH的关系如图所示,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是: .
②电解的最佳pH范围是:(填序号).
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0.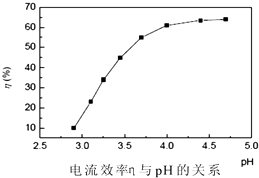
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: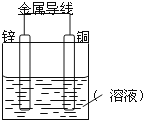
(1)若电解质溶液为稀硫酸,
①Zn棒为原电池的极,其电极反应式为 .
②Cu棒为原电池的极,其电极反应式为 .
(2)若电解质为硫酸铜溶液,
①Cu棒上发生反应,其电极反应式为 .
②若在上述两个过程中,转移电子数相等,则Cu棒上(1)和(2)所析出物质的质量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com