
【题目】pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比( )
A.11:1 B.9 :1 C.1 :11 D.1 :9
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】有一种白色粉末,含有下列阴离子和阳离子中的几种,阴离子:S2-、NO3-、SO42-、CO32-、MnO4-,阳离子:Na+、Al3+、Ba2+、Fe3+、NH4+,将该白色粉末进行下列实验,观察到的现象如下:
a.取少量粉末加水振荡,现象是:全部溶解、溶液无色透明
b.向所得溶液中慢慢滴入苛性钠并加热,现象是:无明显现象
c.取少量粉末加盐酸,现象是:无明显现象
d.取少量粉末加稀硫酸和稀硝酸混合液,现象是:有不溶于稀硝酸的白色沉淀生成。
根据实验推断
(1)从a实验中可推断粉末中一定没有__________________离子;
(2)从b实验中可推断粉末中一定没有__________________离子;
(3)从c实验中可推断粉末中一定没有__________________离子;
(4)从d实验中可推断粉末中必定含有__________________离子;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2、CO、CH4的燃烧热分别为ΔH1=-285.8 kJ/mol、ΔH2=-283 kJ/mol、ΔH3=-890 kJ/mol。H2O(g)=H2O(l) ΔH4=-44 kJ/mol。回答下列问题:
(1)用CH4替代水煤气作家用燃气的优点是____________________。将煤气灶改为天然气灶时,应适当调_________(填“大”或“小”)空气进气阀门。
(2)合成氨厂一般采用烃(以CH4为例)和水蒸气反应制取原料气H2,发生如下反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①该反应的ΔH=________________。
②当该反应达到平衡状态时,下列说法一定正确的是__________(填字母)。
A.v(CH4)=v(CO) B.加入催化剂,ΔH不变
C.升高温度,平衡常数K增大 D.CH4与H2O的转化率相等
③T℃时,该反应的初始浓度与起始速率的部分数据如下:
初始浓度/mol·L-1 | 起始速率/mol3·L-3·s-1 | |
c(CH4) | c(H2O) | v |
0.10 | 0.10 | 1.0×10-4 |
0.10 | 0.20 | 4.0×10-4 |
0.30 | 0.20 | 1.2×10-3 |
写出起始速率与初始浓度的关系式[用c(CH4)、c(H2O)及适当的速率常数表示]v=________。
④T℃时,在一个体积可变的恒压密闭容器中,充入0.1 mol CH4、0.1 mol H2O(g)发生反应,起始时容器的体积为1 L。CH4的转化率与反应时间的关系如图中曲线A所示。则T℃时该反应的平衡常数K=____________。若温度与投料方式相同,该反应在容积为1 L的恒容密闭容器中进行,刚达平衡状态的点是__________(选填B、C、D、E)。
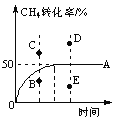
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 用肼(N2H4)还原新制Cu(OH)2 |
方法Ⅲ | 电解法:2Cu+H2O |
已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H = kJ·mol-1
(1)工业上很少用方法Ⅰ制取Cu2O是由于方法Ⅰ反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因: 。
(2)方法Ⅱ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式:阴极 ;阳极 。
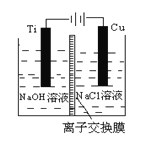
(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+ O2(g) ⊿H >0,水蒸气的浓度(mol·L-1)随时间t (min)变化如下表所示:
2H2(g)+ O2(g) ⊿H >0,水蒸气的浓度(mol·L-1)随时间t (min)变化如下表所示:
序号 | Cu2Oa克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法Ⅱ | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 方法Ⅱ | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | 方法Ⅲ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号)。
a.实验的温度T2小于T1
b.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
c.实验②比实验①所用的催化剂催化效率高
d.实验①、②、③的化学平衡常数的关系:K1=K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol·L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol·L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中,不正确的是
A.2s内的平均反应速率υ(N2)=1.875×10-4mol·L-1·s-1
B.在该温度下,反应的平衡常数K=5
C.若将容积缩小为原来的一半,NO转化率大于90%
D.使用催化剂可以提高单位时间CO和NO的处理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,在一定条件下既能起加成反应,也能起取代反应,但不能使KMnO4酸性溶液褪色的是 ( )
A. 甲烷 B. 苯 C. 乙烯 D. 乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.钠放入水中 Na+H2O=Na++OH-+H2↑
B.电解饱和食盐水 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.实验室用氯化铝溶液和氨水制氢氧化铝 Al3++3OH-=Al(OH)3↓
D.向碳酸氢铵溶液中加入足量氢氧化钠溶液 HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图①﹣⑩分别代表有关反应中的一种物质,请填写以下空白.
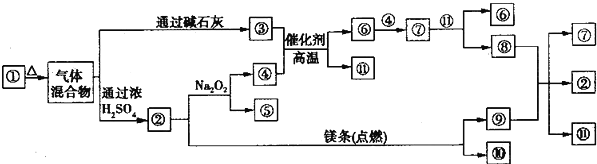
(1)已知①中阴阳离子个数比为1:1,则①的化学式是_________,②的电子式为_________;
(2)图中涉及的氧化还原反应共有_________个
(3)③与④反应的化学方程式为:_______________。
(4)⑧与⑨反应的化学方程式为:_______________。
(5)一定条件下,将2amL④和⑦的混合气体用排水法收集,得amL气体,则原混合气体中④和⑦的体积比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com