
分析 (1)由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,发生还原反应的HCl生成氯气,表现酸性的HCl生成PbCl2;
(2)根据Pb原子守恒计算n(Pb3O4),根据氧原子守恒计算生成氧气物质的量,再根据V=nVm计算氧气体积;
(3)①硫酸铅在水溶液里存在溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成难电离物质或弱电解质醋酸铅,促进硫酸铅溶解,醋酸铅能和硫化钠发生复分解反应生成黑色的硫化铅沉淀;
②+2价Sn的化合物具有强还原性,而+4价的Pb具有氧化性,等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中则发生氧化还原反应,而还原得到Pb2+与硫酸根离子结合为不溶于水的PbSO4.
解答 解:(1)由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,反应方程式为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O,发生还原反应的HCl生成氯气,表现酸性的HCl生成PbCl2,反应中表现还原性的HCl与表现酸性的HCl的物质的量之比为1:1,
故答案为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;1:1;
(2)根据Pb原子守恒,n(Pb3O4)=$\frac{1}{3}$n(PbO2)=$\frac{a}{3}$mol,根据氧原子守恒,生成氧气物质的量=$\frac{amol×2-\frac{a}{3}mol×4}{2}$=$\frac{a}{3}$mol,标况下氧气体积为$\frac{a}{3}$mol×22.4L/mol=$\frac{22.4a}{3}$L,
故答案为:$\frac{22.4a}{3}$;
(3)①硫酸铅在水溶液里存在溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成的醋酸铅,属于难电离物质或弱电解质,促进硫酸铅溶解,所以硫酸铅能溶于醋酸铵溶液中;醋酸铅能和硫化钠发生复分解反应生成黑色的硫化铅沉淀,符合复分解反应的条件,离子反应方程式为(CH3COO)2 Pb+S2-=PbS↓+2CH3COO-,
故答案为:难电离物质或弱电解质;(CH3COO)2 Pb+S2-=PbS↓+2CH3COO-;
②因为+2价Sn的化合物具有强还原性,而+4价的Pb具有氧化性,所以等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中则发生氧化还原反应生成Pb2+和Sn4+,Pb2+与硫酸根离子结合为不溶于水的PbSO4,则溶液中存在的主要金属阳离子是Sn4+,
故答案为:D.
点评 本题考查氧化还原反应有关计算、沉淀溶解平衡与转化等,侧重考查学生分析计算能力,题目难度中等,注意把握电子守恒在氧化还原反应计算中的应用方法.


科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) +2B(g)
+2B(g) xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C.若x<3,C的平衡浓度关系为:c(M)>c(N)
D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
在容积固定的4L密闭容器中进行可逆反应,X(g)+2Y(g) 2Z(g),并达到平衡。在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t关系如图。则图中阴影部分的面积可表示 (
2Z(g),并达到平衡。在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t关系如图。则图中阴影部分的面积可表示 (  )
)
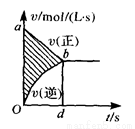
A .X的浓度的减少 B.Y物质的量的减少
.X的浓度的减少 B.Y物质的量的减少
C. Z的浓度的增加 D.X物质的量的减少
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一 | |
| B. | 大力发展新型电动汽车,可以减少燃油汽车的尾气排放量 | |
| C. | 生活中常用的蚕丝、棉花、淀粉、油脂等都是由高分子组成的物质 | |
| D. | 塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地且难以降解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝土矿(Al2O3) | B. | 磁性氧化铁(FeO) | ||
| C. | 铁红(Fe2O3) | D. | 明矾[KAl(SO4)2•12H2O] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com