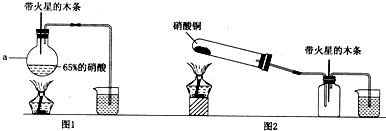
【答案】
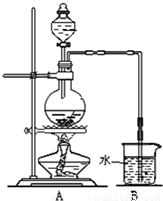
分析:(1)检查气密性可给装置微热,是装置内压强增大,观察是否有气泡或导管内的液面变化判断;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气;
(3)氯水中含有氯气、盐酸和次氯酸,可分别根据这三种物质进行实验设计;
(4)氯气不能直接排放到空气中,应加入尾气处理装置.
解答:解:(1)检查气密性可给装置微热,是装置内压强增大,观察是否有气泡或导管内的液面变化判断,可将倒气管插入盛水的烧杯中,用手捂住圆底烧瓶(或用酒精灯微热圆底烧瓶),倒气管口有气泡冒出.冷却后,倒气管中产生水柱,一段时间没有变化,说明气密性良好,
故答案为:将倒气管插入盛水的烧杯中,用手捂住圆底烧瓶(或用酒精灯微热圆底烧瓶),倒气管口有气泡冒出.冷却后,倒气管中产生水柱,一段时间没有变化,说明气密性良好;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,氧化物、气体、弱电解质写化学式,可溶性的强电解质写离子式,反应的离子方程式为MnO
2+4H
++2C1
-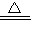
Mn
2++Cl
2↑+2H
2O,
故答案为:MnO
2+4H
++2Cl
-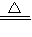
Mn
2++C1
2↑+2H
2O;
(3)①氯水中含有氯气、盐酸和次氯酸,可分别根据这三种物质进行实验设计,首先用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用;然后用把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用,最后用HClO判断能否使布条退色,
故答案为:用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用;氯气使红色布条退色;把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用;
②次氯酸具有强氧化性和漂白性,可使红色布条褪色,故答案为:次氯酸使红色布条退色;
(4)氯气不能直接排放到空气中,应加入尾气处理装置,因氯气可与氢氧化钠反应,则尾气处理装置用氢氧化钠溶液,如图为

,
故答案为:增加尾气吸收装置(或如图
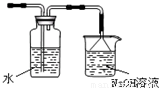
)
点评:本题以氯气的制备和性质实验探究为载体综合考查学生的实验能力和实验设计、评价能力,注意把握物质的性质以及实验方案的设计原理,题目难度中等.

 Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O, Mn2++C12↑+2H2O;
Mn2++C12↑+2H2O; ,
, )
)



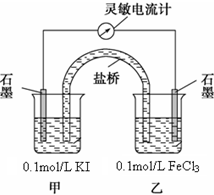 某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.
某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.