
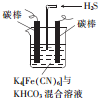
 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.分析 (1)氢化羰基铁为二元弱酸,结合原子守恒分析书写化学方程式;氢化羰基铁为二元弱酸,在溶液中分两步电离;
(2)根据Fe3O4可以写成FeO•Fe2O3,可知1个Fe3O4中有2个铁为+3价,1个铁为+2价来解答;
(3)由铁元素与氧元素的质量比得出该氧化物中铁与氧的个数比,据此写出化学式即可;
(4)依据氧化还原反应的电子守恒计算ZnFe2Oy中Fe元素化合价,再根据化合物中的元素化合价代数为0计算y的值;
(5)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,据此判断;
(6)①Fe3+和Fe2+在溶液中发生水解反应,其物质的量减少;
②pH为3时,c(OH-)=10-11mol/L,结合Ksp(Fe(OH)2)=c(Fe2+)×c2(OH-)=8.0×10-38,Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=4.0×10-38计算c(Fe2+):c(Fe3+).
解答 解:(1)Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼,易于吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠,依据题干信息推知,反应的化学方程式为:Fe(CO)5+H2=H2Fe(CO)4+CO;
氢化羰基铁为二元弱酸,在溶液中分两步电离,其电离方程式为:H2Fe(CO)4?HFe(CO)4-+H+,HFe(CO)4-?Fe(CO)42-+H+;
故答案为:Fe(CO)5+H2=H2Fe(CO)4+CO;H2Fe(CO)4?HFe(CO)4-+H+,HFe(CO)4-?Fe(CO)42-+H+;
(2)因Fe3O4可以写成FeO•Fe2O3,可知1个Fe3O4中有2个铁为+3价,1个铁为+2价,所以由Fe2O3形成一个Fe3O4得到1个电子,则每生成1mol Fe3O4,转移电子的物质的量为1mol;
故答案为:1mol;
(3)设该氧化物的化学式为FexOy,
则56x:16y=28:11,
所以x:y=8:11.
故该化学式为:Fe8O11.
故答案为:Fe8O11;
(4)2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则ZnFe2Oy被还原为ZnFe2O4,令ZnFe2Oy中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合价代数和为0,则2+2×2=2y,解得y=3,
故答案为:3;
(5)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,则阳极的反应为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大;
故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;变大;
(6)①Fe3+和Fe2+在溶液中发生水解反应,其物质的量减少,则1.0 molFe2(SO4)3和1.0mol FeSO4的混合溶液中Fe3+和Fe2+的物质的量之和小于3mol,而硫酸根离子的物质的量为4mol,所以c(SO42-):[c(Fe3+)+c(Fe2+)]>4:3;
故答案为:>;
②pH为3时,c(OH-)=10-11mol/L,则1.0mol FeSO4溶液中c(Fe2+)×c2(OH-)=10-22<8.0×10-16,没有沉淀生成,则c(Fe2+)=1.0mol/L,
由Ksp(Fe(OH)3)=4.0×10-38可知,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-11})^{3}}$mol/L=4×10-5mol/L,则c(Fe2+):c(Fe3+)=2.5×104,
故答案为:2.5×104.
点评 本题以铁的化合物的性质为知识背景,考查了弱电解质的电离、盐的水解原理的应用、电解原理的应用、溶度积常数的计算等,题目综合性较强,难度较大,侧重于考查学生对基础知识的综合应用能力和计算能力.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列有关中和滴定的部分操作顺序正确的是( )
① 标准溶液润洗滴定管;② 往滴定管中注入标准溶液;③ 检查滴定管是否漏水;④ 滴定;⑤ 洗涤滴定管;⑥ 调整滴定管中液面在“0”或“0”以下刻度;⑦记数。
A.⑤①②③④⑥⑦ B.③⑤①②⑥⑦④ C.③⑤②⑦①⑥④ D.②⑥⑦①③⑤④
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
我国“蛟龙”号载人潜水器进行第五次下潜试验,最大深度达到7062米,并安全返回。其动力电源是Al-AgO电池,原理如图所示。下列说法中正确的是

A.Al电极是该电池的正极
B.Ag在AgO/Ag电极上发生氧化反应
C.该电池负极反应是2Al-6e-+8OH-=2AlO2-+4H2O
D.AgO/Ag电极附近溶液中的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 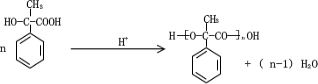 .
.  .
. 和其他无机物叫合成
和其他无机物叫合成 ,最合理的方案
,最合理的方案 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$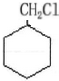 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$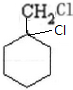
 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:
很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  三甲苯 三甲苯 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. | CH3CH(NH2)CH2COOH α-氨基丁酸 | D. | 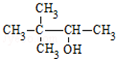 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| B. | 绿矾、碱石灰、苏打、干冰分别属于纯净物、混合物、电解质、非电解质 | |
| C. | 乙烯水化、铁铝钝化、植物油氢化、纯碱晶体风化等过程中都包含化学变化 | |
| D. | 蛋白质、纤维素、硝化纤维等都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

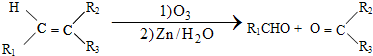
 $\stackrel{一定条件下}{→}$
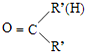
$\stackrel{一定条件下}{→}$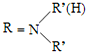 +H2O
+H2O +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O
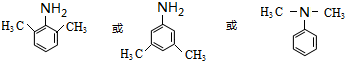 .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com