
| A. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| B. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 | |
| C. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝 | |
| D. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水有漂白性 |
分析 A.发生氧化还原反应生成硫酸,不能比较酸性的强弱;
B.弱酸盐因水解显碱性;
C.铝与氧气反应生成氧化铝的熔点高;
D.氯气和水反应生成盐酸和次氯酸,溶液呈酸性,次氯酸有漂白性.
解答 解:A.SO2与HClO反应生成H2SO4,是HClO的强氧化性所致,不是酸性所致,所以不能得出H2SO4的酸性比HClO强的结论,故A错误;
B.无色酚酞遇碱变红色,向Na2SiO3溶液中滴加酚酞,溶液变红,说明该溶液呈碱性,则硅酸钠水解导致溶液呈碱性,故B正确;
C.铝与氧气反应生成氧化铝的熔点高,则铝箔在酒精灯火焰上加热熔化但不滴落,故C正确;
D.氯气和水反应生成盐酸和次氯酸,溶液呈酸性,则氯水中加入蓝色石蕊试纸变红色,次氯酸有漂白性,所以试纸最后褪色,故D正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化还原反应、次氯酸的漂白性、盐类水解等知识点,易错选项是A,注意次氯酸漂白性具有永久性,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | HX一定是弱酸 | B. | 相同条件下碱性比较:NaX<NaY | ||
| C. | HX可能是强酸 | D. | 反应过程中两者生成H2的速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体属于原子晶体,其化学键比金刚石中的更牢固 | |
| B. | 该晶体中碳原子和氮原子的最外层都满足8电子结构 | |
| C. | 该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构 | |
| D. | 该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b为电源负极 | |
| B. | 该方法是牺牲阳极的阴极保护法 | |
| C. | 电子流向:a→钢铁闸门→辅助电极→b→a | |
| D. | 电源改用导线连接进行防护时,辅助电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
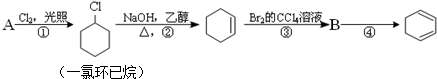
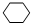 ,①的反应类型是取代反应,③的反应类型是加成反应.反应④的化学方程式是
,①的反应类型是取代反应,③的反应类型是加成反应.反应④的化学方程式是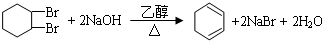
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中PM2.5(2.5微米以下的颗粒物)的存在一定能够形成丁达尔效应 | |
| B. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| C. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物材料 | |
| D. | 水体的富营养化与含N、P洗衣粉广泛使用有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱 酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.75×10-5 | K=4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | 2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| B. | 2CN-+H2O+CO2=2HCN+CO32- | |
| C. | 中和等体积、等pH的HCN和CH3COOH消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的NaCN和CH3COONa溶液中所含离子总数前者小于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com