
分析 (1)碳酸钙不溶于水;
(2)植物油与水分层;
(3)二者溶解度受温度影响不同;
(4)碳酸钙高温分解生成CaO;
(5)有效成分为有机物,易溶于酒精;
(6)二者互溶,但沸点不同.
解答 解:(1)碳酸钙不溶于水,则选择过滤法分离,故答案为:B;
(2)植物油与水分层,则选择分液法分离,故答案为:A;
(3)二者溶解度受温度影响不同,则选择结晶法分离,故答案为:E;
(4)碳酸钙高温分解生成CaO,则选择高温分解法分离,故答案为:F;
(5)有效成分为有机物,易溶于酒精,则该分离方法为萃取,故答案为:C;
(6)二者互溶,但沸点不同,则选择蒸馏法分离出四氯化碳,故答案为:D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意分离方法的选择,题目难度不大.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:实验题
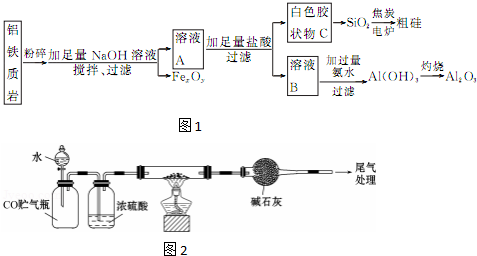
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中水是分散质 | |
| D. | 将所得分散系过滤,在滤纸上能得到分散质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g CH4含有4NA个氢原子 | |
| B. | 2gD216O中含有的质子数为2NA个 | |
| C. | 1 mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| D. | 通常状况下,2.24 L氮气含有0.1NA个N2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
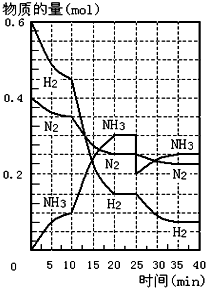 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 (s)浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,一定有化学键的断裂和形成 | |
| B. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 | |
| C. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| D. | 放热反应的反应速率,一定比吸热反应的反应速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com