
| A. | 点石成金 | B. | 酒香不怕巷子深 | C. | 滴水成冰 | D. | 铁棒磨成针 |
分析 A.点石成金此处是指将矿石冶炼为纯金属,生成新物质;
B.酒香不怕巷子深,是因为酒精中含有的分子是在不断运动的,向四周扩散,使人们闻到酒香;
C.滴水成冰过程中,水由液体变成固体;
D.铁棒磨成针的过程中,只是铁棒的形状发生了改变.
解答 解:A.点石成金此处是指将矿石冶炼为纯金属,生成新物质,为化学变化,故A正确;
B.酒香不怕巷子深,是因为酒精中含有的分子是在不断运动的,向四周扩散,使人们闻到酒香,没有生成新物质,属于物理变化,故B错误;
C.滴水成冰过程中,水由液体变成固体,没有生成新物质,属于物理变化,故C错误;
D.铁棒磨成针的过程中,只是铁棒的形状发生了改变,没有生成新物质,属于物理变化,故D错误.
故选A.
点评 本题考查了化学变化的概念,难度不大,看是否生成新物质,也要求我们多关注日常生活中的化学知识,学以致用.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
 ,其六氯代物有3种;
,其六氯代物有3种;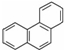 ,其二氯代物的数目为25种;
,其二氯代物的数目为25种; ),其二氯代物有16种.
),其二氯代物有16种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
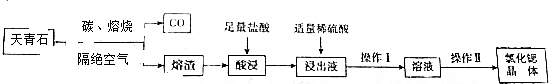
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化硅陶瓷、有机玻璃是传统无机非金属材料 | |
| B. | 瓷坩埚能耐高温,可以用于加热分解石灰石 | |
| C. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
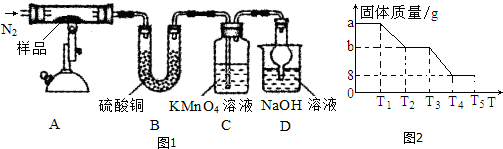
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油在上层,水在下层,汽油层呈无色 | |
| B. | 汽油在下层,水在上层,汽油层呈紫色 | |
| C. | 汽油在上层,水在下层,水层呈无色 | |
| D. | 汽油在上层,水在下层,水层呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 清洁能源所用光电池的生产材料主要是用高纯度的二氧化硅 | |
| C. | 在医疗上氢氧化铝可用于治疗胃酸过多 | |
| D. | 漂白粉在使用时一定要加入一定量的盐酸才能起到漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向石灰水中通入过量CO2 | |
| B. | 向Fe(OH)3胶体中逐滴加入过量H2SO4溶液 | |
| C. | 足量NaOH溶液中逐滴加入Al2(SO4)3溶液 | |
| D. | 向NaAlO2溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com