
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 在上述五种元素形成的单质中,X元素可形成几种同素异形体 | |
| C. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定没有离子键 |
分析 由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2分子,可推出X、Y、Z分别为C、N、O三种元素;
根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;
根据W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,推出W的质子数为$\frac{1}{2}$(6+7+8+1)=11,所以W为Na元素,以此解答该题.
解答 解:由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2分子,可推出X、Y、Z分别为C、N、O三种元素;
根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;
根据W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,推出W的质子数为$\frac{1}{2}$(6+7+8+1)=11,所以W为Na元素,
A.原子半径应是W>X>Y>Z>M(即Na>C>N>O>H),故A错误;
B.X为C元素,对应的单质有金刚石、石墨等几种同素异形体,故B正确;
C.选项中CO2、C2H2 均为直线型共价化合物,而Na2O2 是离子化合物,不是直线型共价化合物,故C错误;
D.X、Y、Z、M四种元素可形成化合物 (NH4)2CO3、NH4HCO3、CO(NH2)2(尿素)等,前二种为离子化合物,而尿素为共价化合物,故D错误.
故选B.
点评 本题综合考查原子结构,元素周期表、元素周期律,分子结构,元素化合物性质等知识,试题难度不大,但题目一反通常习惯,把X、Y、Z、M、W这五种短周期元素,并不是按原子序数依次递增排列的,而只是其中X、Y、Z三种元素是原子序数依次递增的同周期元素,而把原子序数最小的M元素恰恰排在X、Y、Z三种元素后面,这样就给学生设置了一个思维陷阱,如果学生不注意审题,不注意这一细节,一旦陷入习惯上的思维定势,就会跌入这个陷阱,无法正确解题.这也是本题的解题关键.只要掌握了这一解题关键,再结合题给的条件,题目就可迎刃而解.


科目:高中化学 来源: 题型:选择题

| A. | 都能与NaOH溶液反应,每mol消耗NaOH的物质的量之比为1:1 | |
| B. | 都能与溴水反应,每mol消耗Br2的物质的量之比为3:2 | |
| C. | 都能与H2发生加成反应,每mol消耗H2的物质的量之比为4:7 | |
| D. | 都能与O2发生氧化反应,每mol消耗O2的物质的量之比为13:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
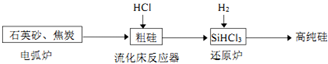
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气跟烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| B. | 漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 将氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是可以燃烧的冰 | |
| B. | 明矾的化学式:KAl(SO4)2 | |
| C. | 酒精、水玻璃、福尔马林都是非电解质 | |
| D. | 肽键是蛋白质一级结构中的主键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ | |
| B. | 四种铈的核素${\;}_{58}^{136}$Ce、${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce,它们互为同位素 | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ | |
| D. | 金属铈应储存于阴凉、通风的地方,包装要密封,不可与空气接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应均是自发反应 | |
| B. | 如果△H和△S为均正值,当高温时,反应可能自发进行 | |
| C. | 物质的量增加的反应,△S为正值 | |
| D. | △S为正值的反应均是自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA的pH=3;BOH的pH=13 | |
| B. | pH=a的HA溶液,稀释10倍,其pH=a+1 | |
| C. | 等体积的HA和BOH恰好完全反应,溶液的pH=7 | |
| D. | 相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com