
| A. | 1.344L | B. | 1.568L | C. | 1.792L | D. | 2.016L |
分析 KMnO4加热分解会得到K2MnO4、MnO2、O2,冷却后放入足量的浓盐酸再加热,Mn元素最终都以MnCl2形式存在,纵观整个过程,根据电子转移守恒,可知Mn元素获得电子等于O元素、Cl元素失去电子,据此计算生成氯气物质的量,进而计算氯气体积.
解答 解:6.32g KMnO4粉末物质的量=$\frac{6.32g}{158g/mol}$=0.04mol,氧气物质的量为$\frac{0.336L}{22.4L/mol}$=0.015mol,
KMnO4加热分解会得到K2MnO4、MnO2、O2,冷却后放入足量的浓盐酸再加热,Mn元素最终都以MnCl2形式存在,纵观整个过程,根据电子转移守恒,可知Mn元素获得电子等于O元素、Cl元素失去电子,则:
0.04mol×(7-2)=0.015mol×4+2×n(Cl2),解得n(Cl2)=0.07mol,
V(Cl2)=0.07mol×22.4L/mol=1.568L,
故选B.
点评 本题考查氧化还原反应的有关计算,难度中等,注意利用电子转移守恒解答,也可以利用方程式计算,但相对比较繁琐.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 181 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心就是如何对被污染的环境进行无毒、无害化的治理 | |
| B. | 海洋中含有丰富的矿产资源,利用蒸馏的方法可以获得NaCl、Br2和Mg等物质 | |
| C. | 加热可杀灭中东呼吸综合征(MERS)冠状病毒,因为病毒的蛋白质受热变性 | |
| D. | 动物体内葡萄糖被氧化成H2O、CO2的同时,伴随着热能转变成化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产中常用静电除尘装置除去废气中的固体悬浮物 | |
| B. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| C. | 一束平行光线照射豆浆时,可看到光亮的通路 | |
| D. | 万里长江流入大海处,形成长江三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 溶液中各离子浓度由大到小的顺序为:c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | |
| C. | 2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | 配制0.1mol•L-1的Na2S溶液时需加少量的KOH抑制S2-的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | Fe2+ | Fe3+ | Al3- | Mg2+ | Ni2+ |
| 开始沉淀的pH值 | 6.5 | 1.6 | 3.4 | 9.4 | 7.2 |
| 完全沉淀的pH值 | 9.7 | 3.2 | 5.4 | 12.4 | 9.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
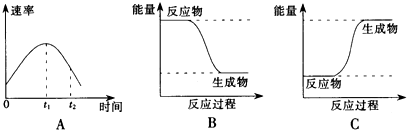
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  该图装置不能这么碳酸与苯酚的酸性强弱 | |
| B. | 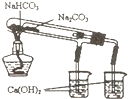 该图可验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 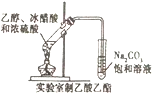 实验室可用该装置制取少量的乙酸乙酯 | |
| D. | 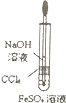 该图装置可用于制备Fe(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com