
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,所以需要加热才能使反应进行 |
| C.该反应的能量变化与化学键变化无关 |
| D.X和Y的总能量一定低于M和N的总能量 |
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源:不详 题型:单选题
| A.断开氢气中的H-H键 |
| B.C与H2O(g)反应 |
| C.Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
| D.Na与H2O反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.①②③ | D.②③④ |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③ | C.①② | D.① |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1  CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1 C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1 CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
 CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
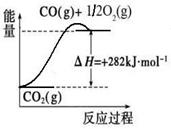
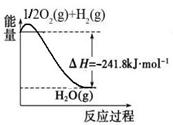
 CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。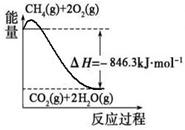
 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。 CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0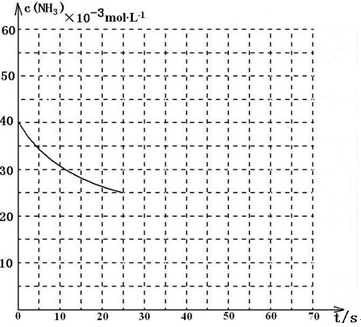
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com