
下列实验设计方案中,可行的是
A.用加入适量铁粉的方法除去Cu(NO3)2溶液中混有的AgNO3
B.用盛有NaOH溶液的洗气瓶除去CO2中混有的HCl气体
C.向某无色未知溶液中加入BaCl2溶液,检验未知溶液中的SO42?
D.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:选择题
一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应:
2A(g)+B(g) 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
t/min | 2 | 4 | 6 | 8 | 10 |
n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
A.反应前2 min的平均速率ν(C) =0.02 mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高二上12月段考化学试卷(解析版) 题型:选择题
反应N2O4(g) 2NO2(g) △H=+57kJ/mol,在温度T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) △H=+57kJ/mol,在温度T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
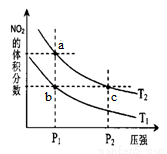
A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a浅,c深
C.a、b两点气体的平均相对分子质量:a>b
D. b、c两点化学平衡常数:b<c
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:填空题
过渡元素在生活、生产和科技等方面有广泛的用途。
(1)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+________(填“有”或“无”)颜色。
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________。(填序号)
A.PFS中铁显+3价
B.铁原子的外围电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
元素 | Mn | Fe | |
电离能 | I1 | 717 | 759 |
(kJ·mol-1)[ | I2 | 1 509 | 1 561 |
I3 | 3 248 | 2 957 | |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为: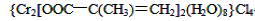
①该化合物中存在的化学键类型有______________________________。
②甲基丙烯酸分子中C原子的杂化方式有________。
③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是________(填一种即可)。
④与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:选择题
在半导体生产或灭火剂的使用中,会向空气逸出气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体。下列推测不正确的是 ( )
A.由价层电子对互斥理论可确定NF3分子呈三角锥型
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上第二次质检化学试卷(解析版) 题型:选择题
短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第ⅤA族,A和C同主族,D原子最外层电子数与电子层数相等。下列叙述正确的是
A.原子半径:C<B
B.元素A、C的氧化物均为共价化合物
C.金属性:D>C
D.元素B、C、D的最高价氧化物对应水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高一上第二次月考化学试卷(解析版) 题型:填空题
(1)赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S。赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O===6Cu+SO2。氧化剂是________,还原剂是________每生成19.2 g Cu,反应中转移电子数_________
(2)已知8NH3+3Cl2 = 6NH4Cl+N2,氧化剂与还原剂的分子个数比为________;当有4mol NH3被氧化时,生成的还原产物为________ g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一12月月考化学试卷(解析版) 题型:选择题
有下列三个氧化还原反应:①2FeCl3+2KI=2KCl+2FeCl2+I2 ②2FeCl2+Cl2═2FeCl3③2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑若某FeCl2溶液中有I-共存,要氧化除去I-而又不减少Fe2+和Cl-,可加入的试剂是
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第五次月考化学试卷(解析版) 题型:选择题
将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是
A.c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)
B.c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
D.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com