
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法不正确的是
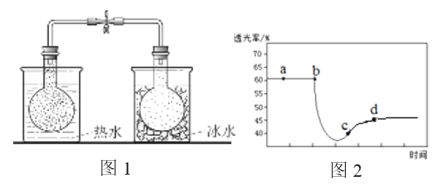
A. 图1现象说明该反应为放热反应
B. 图2中b点的操作是压缩注射器
C. c点:v(正)>v(逆)
D. 若没有能量损失,考查体系温度变化,则T(d)<T(c)
【答案】D
【解析】
图1现象说明热水中颜色深,升温平衡向逆反应即吸热方向移动,则该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,后来平衡正向移动,气体颜色变浅,透光率增大,据此分析。
A、图1现象说明热水中颜色深,升温平衡向逆反应即吸热方向移动,则该反应是正反应气体体积减小的放热反应,选项A正确;B、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,选项B正确;C、c点平衡正向移动,气体颜色变浅,透光率增大,所以v(正)>v(逆),选项C正确;D、c点以后平衡正向移动,气体颜色变浅,透光率增大,又反应放热,导致T(c)<T(d),选项D错误;答案选D。


科目:高中化学 来源: 题型:
【题目】有机物的结构可用键线式简化表示,如CH3-CH=CH-CH3可表示为![]() ,有一种有机物X的键线式如图所示。
,有一种有机物X的键线式如图所示。
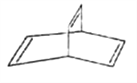
(1)X的分子式为_______________________。
(2)有机物Y是X的同分异构体,且属于芳香族化合物。则Y的结构简式是_____________。
(3)Y在一定条件下可发生反应生成高分子化合物,该反应的化学方程式是_________________。
(4)Y可以与溴水反应,该反应的化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含单键又含双键的是 ( )
A.CO2B.C2H4OC.COCl2D.H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
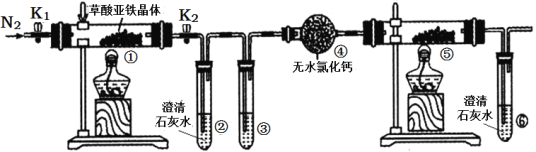
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 第3周期元素的简单离子中半径最小 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________(用元素符号表示),元素Z的离子结构示意图为__________。
(2)元素Y与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是____________________。
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式: ____________________。
(4)元素X与元素Y相比,非金属性较强的是__________(用元素符号表示)。
(5)探寻物质的性质差异性是化学学习的重要方法之一。X、Y、Z三种元素的单质中化学性质明显不同于其他两种单质的是__________(用元素符号表示),理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实促熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳、氢两种元素组成,碳元素与氢元素的质量比为12∶1,B的相对分子质量为78。回答下列问题:
(1)A的电子式为____________________,A的结构简式为____________________。
(2)A可以使溴的四氯化碳溶液褪色的化学反应方程式为: _________,反应类型为__________。
(3)在碘水中加入B振荡静置后的现象为___________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式为: ___________,反应类型为__________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量__________(填"A>B""A<B"或"A=B")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾(KIO3)在生活中应用广泛,可将含碘物质经过系列变化得到KIO3。
(方法一)现向含6 mol KI的稀硫酸中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与加入KBrO3的物质的量的关系如图所示。
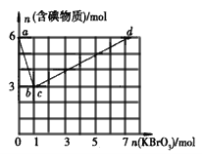
已知 ①a→b段:BrO3-+6I-+6H+=3I2+Br-+3H2O
②c→d段:2BrO3-+I2=2IO3-+Br2
回答下列问题:
(1)b点时,KI完全反应,则消耗的氧化剂与还原剂的物质的量之比是________,还原产物是_____________;a→b共转移________mol e-。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子方程式:_____________;从反应开始到达c点时,共消耗n(KBrO3)=____________mol。
(方法二)电解法制备KIO3,现将一定量的碘溶于过量的氢氧化钾溶液,发生反应:aI2+bKOHcKI+dKIO3+eX,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解,得到KIO3。回答下列问题:
(3)X的化学式是____________。
(4)若有0.3mol I2单质参加反应,则反应过程中电子转移的个数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Zn(s)===Zn2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的________极,发生的电极反应为____________________;X电极上发生的电极反应为_________________________________________;
(3)外电路中的电子是从______电极流向______电极。
(4)若该电池中两电极的总质量为100g,工作一段时间后,锌片质量减轻了13g,试计算,银电极质量增重_________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com