
| A. | 当溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-)时,一定是醋酸过量 | |
| B. | 当溶液中c(CH3COO-)=c(Na+)时,一定是氢氧化钠过量 | |
| C. | 当溶液中c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全反应 | |
| D. | 当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
分析 A.CH3COONa是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则CH3COOH应该稍微过量;
B.当溶液中c(CH3COO-)=c(Na+)时,根据电荷守恒知c(H+)=c(OH-),溶液呈中性;
C.醋酸与氢氧化钠恰好完全反应时,二者生成醋酸钠,溶液呈碱性;
D.当液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,溶液呈碱性,溶液中溶质可能是醋酸钠或醋酸钠和少量醋酸或醋酸钠和少量氢氧化钠.
解答 解:A.等物质的量的醋酸与NaOH反应生成醋酸钠溶液显碱性,而c (H+)=c(OH-)时,溶液显中性,所以醋酸过量,故A正确;
B.根据电荷守恒规律,当溶液中c(CH3COO-)=c(Na+)时,c (H+)=c(OH-),溶液呈中性,醋酸钠溶液呈碱性,要使混合溶液呈中性,所以醋酸过量,故B错误;
C.根据B知,溶液呈中性,醋酸与氢氧化钠不是恰好完全反应,醋酸过量,故C错误;
D.溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,说明溶液显碱性,溶液中溶质可能是醋酸钠或醋酸钠和少量醋酸或醋酸钠和少量NaOH,故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液酸碱性及溶液中溶质性质是解本题关键,可以采用逆向思维方法分析解答,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 苏打 | 水 | 氨气 |
| B | 氢氧化钡 | 氢氧化铁胶体 | 硫酸钡 | 氨水 | 乙醇 |
| C | 明矾 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| D | 石灰石 | 水玻璃 | 氯化钙 | 氢氧化铝 | 碳酸钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
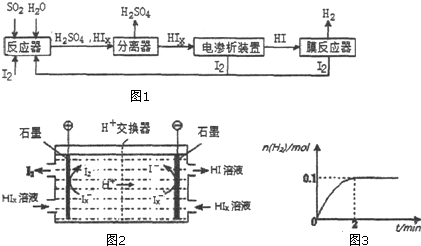
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下的平衡常数为101.25 L/moL | |
| B. | 达到平衡时,SO2的转化率是90% | |
| C. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为231.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com