
 氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在.某工厂处理氨氮废水的流程如下:
氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在.某工厂处理氨氮废水的流程如下:分析 (1)铵根能和强碱反应生成一水合氨;减少生成物,可以使化学平衡向正反应方向移动;
(2)①加入的NaClO与水体中NH4+的物质的量之比根据2NH4+~N2~12e-,ClO-~Cl-~2e-结合得失电子守恒计算;
②中a-b点,发生的反应为i.ClO-+H+═HClO
ii.NH4++HClO═NH2Cl+H++H2O (NH2Cl中Cl元素为+1价),b-c点反应是次氯酸钠和NH2Cl发生氧化还原反应生成氮气,结合电荷守恒和原子守恒写出离子方程式;
(3)处理10m3盐水b中含有NaClO的物质的量为n=$\frac{1000L×10×7.45×1{0}^{-3}g/L}{74.5g/mol}$=1mol
根据反应:NaClO+Na2SO3═NaCl+Na2SO4,可知与NaClO完全反应消耗的Na2SO3为1mol.
解答 解:(1)铵盐能和强碱反应,实质是:NH4++OH-═NH3•H2O,氨水电离是可逆反应,鼓入大量空气将生成的氨气带走,即减少生成物,可以使化学平衡向正反应方向移动,即更多的生成氨气,因而促进了氨水电离,
故答案为:NH4++OH-═NH3•H2O;空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离;
(2)①氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在,为了完全从废水中去除氨氮,
2NH4+~N2~12e-
6ClO-~6Cl-~12e-
根据电子守恒得到加入的NaClO与水体中NH4+的物质的量之比3:1,
故答案为:3:1;
②中a-b点,发生的反应为i.ClO-+H+═HClO
ii.NH4++HClO═NH2Cl+H++H2O (NH2Cl中Cl元素为+1价),b点表示的溶液中氮元素的主要存在形式是NH2Cl,
b-c点反应是次氯酸钠和NH2Cl发生氧化还原反应生成氮气,反应的离子方程式为:ClO-+2NH2Cl=N2+3Cl-+2H++H2O,
故答案为:NH2Cl;ClO-+2NH2Cl=N2+3Cl-+2H++H2O;
(3)处理10m3盐水b中含有NaClO的物质的量为n=$\frac{1000L×10×7.45×1{0}^{-3}g/L}{74.5g/mol}$=1mol
根据反应:NaClO+Na2SO3═NaCl+Na2SO4,可知与NaClO完全反应消耗的Na2SO3为1mol,
质量为m=n×M=1mol×126g/mol=126g,
根据题意,设最多添加10%Na2SO3溶液的质量为x
$\frac{(x×10%-126g)×1{0}^{3}mg/g}{1000L}$=5mg/L,
解得:x=1760g=1.76kg,
故答案为:1.76.
点评 本题考查了废水处理的方法和过程分析判断,氧化还原反应电子守恒的计算、氧化还原反应产物判断,注意分析题干信息,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)在O2(g)中燃烧的反应是放热反应 | |
| B. | 16g固体硫在空气中充分燃烧,可放出148.6 KJ的能量 | |
| C. | 1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | S(g)+O2(g)═SO2(g)△H=b KJ•mol-1,则a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 简单离子半径:W>Z>Y>X | |
| D. | 四种元素的单质中,Z的熔、沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加CuSO4溶液 | B. | 选用质量分数为98%的浓硫酸 | ||
| C. | 不用铁片,改用等质量的铁粉 | D. | 增加稀硫酸的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在元素周期表中金属与非金属分界线左边的元素均为金属元素 | |
| B. | Na、Mg、Al的还原性依次减弱 | |
| C. | F、Cl、Br的非金属性依次增强 | |
| D. | NaOH、KOH、Mg(OH)2的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )
已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )| A. | H2O的电子式为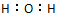 | B. | Z的沸点低于H2O的沸点 | ||
| C. | X+含有离子键 | D. | 含有Y-的溶液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )
某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )| A. | 3:2:5 | B. | 3:3:4 | C. | 3:2:4 | D. | 1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com