
| 放电 |
| 充电 |
| A、放电时,负极的电极反应式为:Pb-2e-═Pb2+ |
| B、放电时,正极得电子的物质是PbO2 |
| C、充电时,电解质溶液中硫酸浓度减小 |
| D、充电时,阴极的电极反应式为:PbSO4-2e-+2H2O═PbO2+4H++SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ① | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ga3N2 |
| B、Ga2N3 |
| C、GaN |
| D、Ga3N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑦⑤④⑥①②③ |
| B、⑥③⑦⑤④①② |
| C、⑥⑦⑤③④①② |
| D、⑥⑦③⑤④②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
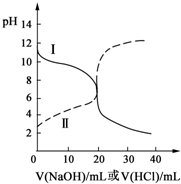 25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A、曲线Ⅰ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D、曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
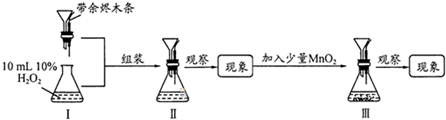
| A、实验时先加H2O2后加MnO2有利于增大固液接劁 |
| B、为使实验顺利进行,H2O2不宜从图Ⅱ漏斗处加入 |
| C、Ⅱ、Ⅲ处均可观察到迅速产生大量气泡,余烬复燃 |
| D、上述流程中不宜先加入MnO2再插入带余烬的木条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 此图用于放出碘的四氯化碳溶液 |
B、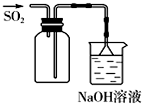 此图用于实验室收集SO2 |
C、 此图用于实验室制备Fe(OH)2 |
D、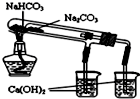 此图用于比较NaHCO3和Na2CO3热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com