
| A. | 呈碱性 | B. | 呈酸性 | C. | 呈中性 | D. | 无法判断 |
分析 溶液酸碱性取决于溶液中c(OH-)、c(H+)的相对大小,当c(OH-)>c(H+),溶液呈碱性,当c(OH-)=c(H+),溶液为中性,当c(OH-)<c(H+),溶液为酸性;先根据该温度下水的离子积计算出溶液中氢氧根离子浓度,然后根据c(OH-)、c(H+)的相对大小判断该溶液的酸碱性.
解答 解:100℃时,水的离子积为1×10-12,该温度下某溶液中的c(H+)为10-7 mol•L-1,
则该溶液中氢氧根离子的浓度为:c(OH-)=$\frac{1×1{0}^{-12}}{1×1{0}^{-7}}$mol/L=1×10-5mol•L-1,故c(OH-)>c(H+),该溶液呈碱性,
故选A.
点评 本题考查了溶液酸碱性判断,题目难度不大,明确溶液酸碱性与氢离子、氢氧根离子浓度之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 成语、谚语、俗语 | 理解或寓意 |
| A | “甘之如饴” | 糖类均有甜味 |
| B | “冰、水为之,而寒于水” | 相同质量和温度的水和冰,冰的能量高 |
| C | “雷雨肥庄稼” | 农作物生长需要水,雷雨天提供了大量的雨水 |
| D | “春蚕到死丝方尽” | 蚕丝的只要成分是蛋白质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 还原性 H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | M与T形成的化合物能与NaOH溶液反应 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
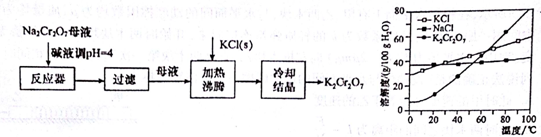
 Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.
Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
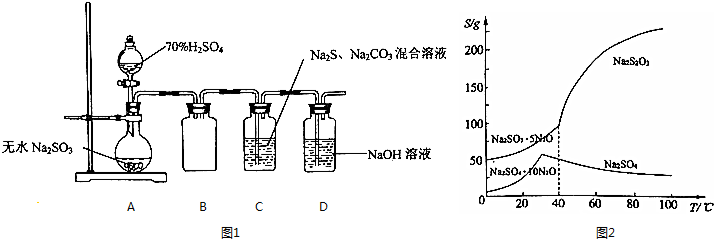
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com