
【题目】异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2 .
完成下列填空:
(1)化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3﹣甲基﹣1,1,2,2﹣四溴丁烷.X的结构简式为 .
(2)异戊二烯的一种制备方法如图所示:
A能发生的反应有 . (填反应类型)
B的结构简式为 .
(3)设计一条由异戊二烯制得有机合成中间体 ![]() 的合成路线. (合成路线常用的表示方式为:A
的合成路线. (合成路线常用的表示方式为:A ![]() B…
B… ![]() 目标产物)
目标产物)
【答案】
(1)CH≡CCH(CH3)2
(2)加成(还原)、氧化、聚合、取代(酯化)、消除反应;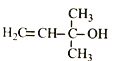
(3)

【解析】(1)化合物X与异戊二烯的分子式相同,则X的分子式为C6H10 , X的不饱和度为2,X与Br2/CCl4发生加成反应产物为3﹣甲基﹣1,1,2,2﹣四溴丁烷,则X分子中存在碳碳三键,其结构简式为:CH≡CCH(CH3)2 , 所以答案是:CH≡CCH(CH3)2;
(2)A分子中存在碳碳双键能发生加成反应,与H2的加成反应也属于还原反应,能被酸性高锰酸钾溶液氧化而发生氧化反应,能发生加聚反应(聚合反应),A分子中存在羟基能发生取代反应(酯化反应)和消除反应,
将A与异戊二烯的结构简式对比可知,A首先与H2发生加成反应,使叁键变双键 ,再发生消除反应即可得到异戊二烯,所以答案是:加成(还原)、氧化、聚合、取代(酯化)、消除反应; 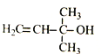 ;
;
(3)CH2=C(CH3)CH=CH2在一定条件下先与HCl发生加成反应生成CH2=C(CH3)CH2CH2Cl,然后CH2=C(CH3)CH2CH2Cl在氢氧化钠溶液、加热条件下发生取代(水解)反应生成CH2=C(CH3)CH2CH2OH,最后CH2=C(CH3)CH2CH2OH在催化剂、加热条件下与H2发生加成反应即可生成CH3CH(CH3)CH2CH2OH,所以答案是:  .
.


科目:高中化学 来源: 题型:
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)△H=a kJmol﹣1 .
N2(g)+2CO2(g)△H=a kJmol﹣1 .
(1)已知:2NO(g)+O2(g)=2NO2(g)△H=b kJmol﹣1;CO的燃烧热为c kJmol﹣1 . 写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式 .
(2)一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/molL﹣1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
c(CO)/molL﹣1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |
①在恒容密闭容器中充入CO,NO气体,下列图象如图1正确且能说明反应达到平衡状态的是 . 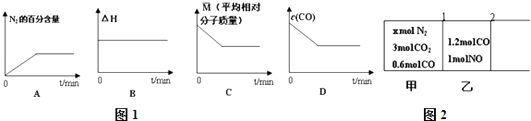
②前2s内的平均反应速率υ(N2)=mol/(Ls)(保留两位小数,下同);此温度下,该反应的平衡常数为 .
③采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx , 获得(NH4)2SO4的稀溶液.已知常温下,该溶液的PH=5,则 ![]() =(已知该温度下NH3H2O的Kb=1.7×10﹣5).若向此溶液中再加入少量 (NH4)2SO4固体,
=(已知该温度下NH3H2O的Kb=1.7×10﹣5).若向此溶液中再加入少量 (NH4)2SO4固体, ![]() 的值将(填“变大”、“不变”或“变小”).
的值将(填“变大”、“不变”或“变小”).
(3)如图2所示,用无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下达到平衡时,各部分体积分别为V甲、V乙 . 此时若去掉活塞1,不引起活塞2的移动.则x= , V甲:V乙= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如右图,则合金中镁和铝的质量比是( ) 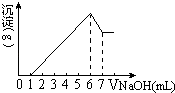
A.1:1
B.8:9
C.4:3
D.4:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸法钛白粉生产中的副产物(主要成分是绿矾、少量TiO2及重金属离子)制备高品质氧化铁红的工艺过程如图1: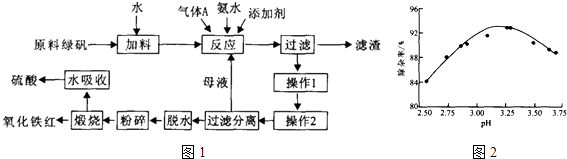
(1)原料绿矾需要加入铁粉进行预处理,其目的为(用离子方程式表示).
(2)利用氨水中和反应可以促进重金属离子水解,以便沉淀出去,如图为pH与除杂率的关系.气体A为(填化学式),调节pH适宜范围为 .
(3)操作1和操作2分别为
(4)绿矾通过脱水、锻烧等工序转化为氧化铁红.反应为:FeSO47H2O ![]() FeSO4H2O+6H2O↑:
FeSO4H2O+6H2O↑:
(5)该过程中可循环使用的物质为(填化学式).
(6)若生产1t钦白粉会产生3t含量为96.5%的绿矾原料,生产中损失5%,则高品质氧化铁红的产量为 t
(7)TiO2可用于制备海绵钛:
①已知:
(i)TiO2(g)+2C12(g)═TiC14(1)+O2(g)△H=+141kJmol﹣1
(ii)TiO2(g)+C(s)+2C12(g)═TiC14(1)+CO2(g)△H=﹣218kJmol﹣1
工业上采用(ii)制备TiC14 , 不能采用(i)的原因是 . 02Mg在高温下还原TiC14制备海绵钦的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以2010年诺贝尔化学奖获得者的名字命名的赫克反应、根岸反应和铃木反应已成为化学家们制造复杂化学分子的“精致工具”,在科研、医药和电子等领域已经广泛应用.下例生成物就是由铃木反应合成出来的一种联苯的衍生物:![]()
下列叙述正确的是( )
A.该反应为加成反应,且原子利用率达100%
B.该联苯的衍生物属于芳香烃
C.该联苯的衍生物苯环上的一硝基取代产物有5种
D.该联苯的衍生物不可使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m:n
B.25℃时,1kg气体A与1kg气体B的分子数之比为n:m
C.同温同压下,气体A与气体B的密度之比为m:n
D.标准状况下,等质量的A与B的体积比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某无色溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )
A. CO32-、Cl- B. Na+、Cu2+
C. Mg2+、Cl- D. Cl-、Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
请回答下列问题:
(1)环戊二烯分子中最多有个原子共平面;
(2)金刚烷的分子式为 , 其分子中的CH2基团有个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应①的产物名称是 , 反应③的反应类型是;
(4)已知烯烃能发生如下反应:
![]()
![]() RCHO+R′CHO
RCHO+R′CHO
请写出下列反应产物的结构简式: 
![]()
![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题.
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是 .
(2)由图1和图2判断使用硫杆菌的最佳条件为 . 若反应温度过高,反应速率下降,其原因是 . 
(3)方法2:在一定条件下,用H2O2氧化H2S
随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同.当n(H2O2)/n(H2S)=4时,氧化产物的分子式为 .
(4)Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
写出过程①的离子方程式:;CaO在水中存在如下转化:
CaO(s)+H2O (l)═Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)
从平衡移动的角度,简述过程②NaOH再生的原理 .
(5)方法2:用氨水除去SO2
已知25℃,NH3H2O的Kb=1.8×10﹣5 , H2SO3的Ka1=1.3×10﹣2 , Ka2=6.2×10﹣8 . 若氨水的浓度为2.0molL﹣1 , 溶液中的c(OH﹣)=molL﹣1 . 将SO2通入该氨水中,当c(OH﹣)降至1.0×10﹣7 molL﹣1时,溶液中的c(SO32﹣)/c(HSO3﹣)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com