
【题目】某学习小组同学为探究同周期元素性质的递变规律,设计了如下实验。
(1)将等质量的钠、镁、铝分别投入到足量的相同浓度的盐酸中,试预测实验结果:上述金属中___(填化学式,下同)与盐酸反应最剧烈,___与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊现象,可证明S、Cl元素非金属性强弱顺序为___,反应的离子方程式为___。
【答案】Na Al C1>S Cl2+S2-=2Cl-+S↓
【解析】
(1)根据金属性越强,与盐酸反应越剧烈进行分析,根据得失电子数目守恒进行分析;
(2)出现淡黄色沉淀,说明有S单质生成,Cl2将S2-氧化成S,根据氧化还原反应的规律判断出非金属性的强弱;
(1)利用金属性越强,与酸反应越剧烈,金属活泼性顺序为钠 >镁 >铝,因此相同条件下与盐酸反应最剧烈的是钠,反应速率最小的是铝;根据得失电子守恒守恒,有n(Na)×1=n(H2)×2、n(Mg)×2=n(H2)×2、n(Al)×3=n(H2)×2,相同质量(设均为m)的三种金属的物质的量分别是![]() 、
、![]() 、
、![]() ,代入上式,得出等质量的上述金属与足量的相同浓度的盐酸反应生成氢气最多的是金属铝;
,代入上式,得出等质量的上述金属与足量的相同浓度的盐酸反应生成氢气最多的是金属铝;
(2)硫化钠溶液中通入氯气,出现淡黄色浑浊,说明生成硫单质,氯气的氧化性强于硫单质,Cl2将S2-氧化成S,根据氧化剂的氧化性强于氧化产物的氧化性,推出Cl的非金属性强于S,反应的离子方程式为Cl2+S2-=2Cl-+S↓。


科目:高中化学 来源: 题型:
【题目】实验:①0.005mol·L-1FeCl3溶液和0.015mol·L-1KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析不正确的是( )
A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-![]() Fe(SCN)3正向移动
Fe(SCN)3正向移动
B.实验③中有Fe(OH)3生成
C.实验③和④中溶液颜色变浅的原因相同
D.实验②、③、④均可说明浓度改变对平衡移动的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4 溶液显酸性,关于 NaHC2O4 溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4)
)+c(H2C2O4)
C.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.c(H+)+c(H2C2O4)=c(![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子。某同学对该溶有进行了如下实验:
中的若干种离子。某同学对该溶有进行了如下实验:

下列判断正确的是
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、![]() 和
和![]() 一定存在于溶液X中
一定存在于溶液X中
D.![]() 和
和![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,将0.1 mol Fe(NO3)3和2 mol HCl溶于水得到2L混合溶液,然后向该溶液中投入m g铁粉,充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是
A.由于氧化性:Fe3+>H+,故首先发生的反应是Fe+2Fe3+=3Fe2+
B.充分反应后,共消耗56 g铁
C.m=28时,溶液剩余0.9 mol H+
D.当加入16.8 g铁粉时,可生成标准状况下6.72 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1 mol O2(g)中的化学键需要吸收498 kJ的能量。根据能量变化示意图,下列说法不正确的是
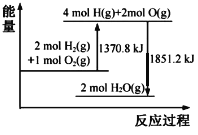
A.2H2(g)+O2(g)=2H2O(l) △H=-480.4 kJ·molˉ1
B.H2O(g)=H2(g)+![]() O2(g) △H=240.2 kJ·molˉ1
O2(g) △H=240.2 kJ·molˉ1
C.拆开1 mol H2(g)中的化学键需要吸收436.4 kJ的能量
D.H2(g)和O2(g)形成H2O(g)中的1 mol H-O键放出462.8 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同时存在以下反应:积碳反应:CH4(g)C(s)+2H2(g) ΔH=+75 kJ·mol1,消碳反应:CO2(g)+C(s)2CO(g) ΔH=+172 kJ·mol1,积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如图。下列说法正确的是

A.高压利于提高 CH4 的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
D.温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快, 积碳量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究浓度对2Fe3+ + 2I-2Fe2+ + I2 的影响,进行如下实验:

下列说法不正确的是
A.Ⅱ中加入的 SCN-结合Fe3+使平衡向左移动
B.Ⅲ中含有 I2
C.比较水溶液中的 c(I-):II>Ⅳ
D.比较水溶液中的 c(Fe3+):Ⅳ>I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】营养平衡与人体健康:
(1)营养均衡有利于身体健康。秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:

①属于糖类的有:阿拉伯果糖、___。
②蛋白质在人体内水解的最终产物为___。
③人体缺乏某种微量元素会发生贫血,这种微量元素是___。
④属于水溶性维生素的是___,缺乏该维生素会引起___。
(2)如图为某品牌酱油标签的一部分。

①氨基酸态氮的含量是酱油质量的重要指标,这些氨基酸是由大豆中的主要营养物质___水解而来。
②配料清单中属于防腐剂的是___。
③小麦中的主要营养物质是___。
(3)了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。
①其中属于解热镇痛的药物是___;
②青霉素作用是___。
③药片常用淀粉作为黏合剂,淀粉水解最终产物是___。
④某胃药的主要成分是AlaMgb(OH)cCO3。常用于冶疗胃酸过多,写出其与胃酸反应的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com