
| A. | 橡胶 | B. | 蛋白质 | C. | 油脂 | D. | 淀粉 |
分析 高分子化合物相对分子质量特别大一般达1万以上、一般具有重复结构单元.有机高分子化合物可以分为天然有机高分子化合物(如淀粉、纤维素、蛋白质、天然橡胶等)和合成有机高分子化合物(如聚乙烯、聚氯乙烯等),它们的相对分子质量可以从几万直到几百万或更大,但他们的化学组成和结构比较简单,往往是由无数(n)结构小单元以重复的方式排列而成的.
解答 解:A.天然橡胶的成分是聚异戊二烯,是高分子化合物,故A正确;
B.蛋白质为天然有机高分子化合物,故B正确;
C.油脂相对分子质量较小,不属于高分子化合物,故C错误;
D.淀粉是高分子化合物,故D正确.
故选C.
点评 本题考查了高分子化合物,难度较小,清楚高分子化合物概念及常见的天然高分子化合物即可解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )
可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )| A. | 化学方程式中:m+n>e | |
| B. | 达到平衡后,使用催化剂,C的体积分数将增大 | |
| C. | 达到平衡后,若温度升高,化学平衡向逆反应方向移动 | |
| D. | 达到平衡后,若增大体系的压强,化学平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气除去乙烯 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,先加入稀硫酸酸化,再滴加硝酸银溶液 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 实验室制取乙炔时,常用饱和食盐水代替水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有极性键的分子一定是极性分子 | B. | 单质分子一定是非极性分子 | ||
| C. | 氢键一定与氢元素有关 | D. | 共价键只存在于非金属元素之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (A-)+c (HA)=0.1mol/L | B. | c (Na+)-c (A-)=1×10-6-1×10-8mol/L | ||
| C. | c (OH-)-c (HA)=1×10-8mol/L | D. | c(Na+)>c(OH-)>c(A)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
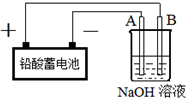 Cu2O是一种半导体材料,实验室用铅酸蓄电池电解一定浓度的NaOH溶液制备Cu2O,方程式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑装置如图所示,回答下列问题
Cu2O是一种半导体材料,实验室用铅酸蓄电池电解一定浓度的NaOH溶液制备Cu2O,方程式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑装置如图所示,回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com