
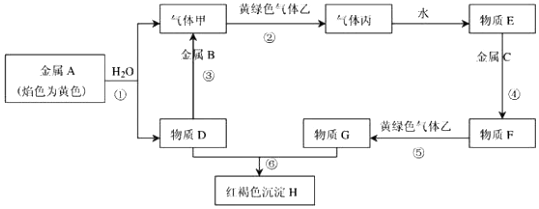
分析 金属A颜色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2;判断C为Fe,据此答题.
解答 解:金属A颜色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2;判断C为Fe,
(1)依据分析A为Na,B为Al,C为Fe,H为Fe(OH)3,乙为Cl2,丙为HCl,E为盐酸溶液,
故答案为:Fe;Cl2;
(2)①反应是钠和水的反应:2Na+2H2O=2NaOH+H2↑;
故答案为:2Na+2H2O=2NaOH+H2↑;
反应⑤是氯化亚铁和氯气反应生成氯化铁的反应:2FeCl2+Cl2=2FeCl3 ;
故答案为:2FeCl2+Cl2=2FeCl3 ;
反应⑥是氢氧化钠和氯化铁反应的化学方程式为:3NaOH+FeCl3=Fe(OH)3↓+3NaCl;
故答案为:3NaOH+FeCl3=Fe(OH)3↓+3NaCl.
点评 本题考查了物质转化关系的分析推断,物质性质的应用主要考查常见单质及其化合物的性质应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3→Al2O3 | B. | SiO2→H2SiO3 | C. | Al→AlO2- | D. | Si→Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
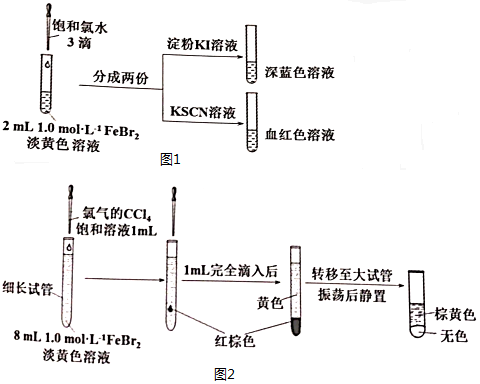
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③⑥ | C. | ②③ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加大清洁能源的开发利用,提髙资源的利用率 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 用沼气、太阳能、风能等新型能源代替化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
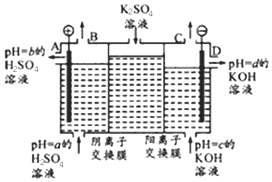
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙烷(乙烯) | 溴的四氯化碳溶液 | 洗气 |
| B | 硝基苯(硝酸) | H2O | 过滤 |
| C | 溴苯(溴) | NaOH溶液 | 分液 |
| D | 乙烯(SO2) | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com