
| 序号 | V初 | V末 | V标 |
| 1 | 0.10mL | 9.71mL | 9.61mL |
| 2 | 1.50mL | 11.09mL | 9.59mL |
| 3 | 0.50mL | 11.10mL | 11.60mL |
分析 (1)亚铁离子被酸性溶液中的高锰酸钾反应生成铁离子和锰离子、水;
(2)配制溶液的操作步骤选择需要的仪器;
(3)高锰酸钾溶液具有强氧化性,不能使用碱式滴定管盛放,应该选用酸式滴定管,若滴定过程中,锥形瓶中待测液飞溅出来,测定的亚铁离子增大;
(4)分析可知标准溶液体积.实验3误差太大舍去,依据实验1、2计算平均值,结合化学方程式定量关系计算亚铁离子反应的物质的量,该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)计算氧化率;
解答 解:(1)MnO4-中Mn的化合价由+7价降为+2价,变化5,Fe2+中Fe由+2价升为+3价,变化1价,根据化合价升降总数相等和质量守恒得:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
故答案为:5,1,8H+,1,5Fe3+,4H2O;
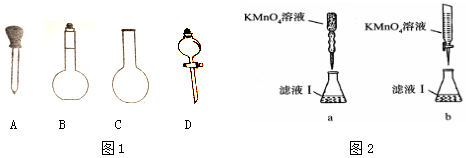
(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是分液漏斗、圆底烧瓶,
故答案为:烧瓶(园底烧瓶) 分液漏斗;
(3)酸性高锰酸钾溶液具有强氧化性,应该用酸式滴定管盛放,所以a错误、b正确,若滴定过程中,锥形瓶中待测液飞溅出来,测定的亚铁离子增大,亚铁离子氧化率增大,
故答案为:b;偏高;
(4)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,铁元素质量=20.00%×20.0g=4.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L-1的KMnO4溶液滴定,分析可知标准溶液体积.实验3误差太大舍去,平均消耗标准溶液体积V=$\frac{9.61ml+9.59ml}{2}$=9.6ml,
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
1 5
0.0096L×0.1000mol/L-1 n
n=0.0048mol,
配制成250ml溶液中铁元素物质的量=$\frac{250}{20}$×0.0048mol=0.06mol,
该“速力菲”补铁药品Fe2+的转化率=$\frac{0.06mol×56g/mol}{4.0g}$×100%=84%,
国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值),则该“速力菲”补铁药品Fe2+的氧化率为16%,
故答案为:16.
点评 本题考查了中和滴定、化学方程式书写、化学计算等知识,题目难度中等,主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增强了学生整合知识的能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T表示同一种核素 | B. | O2-离子的原子结构示意图: | ||
| C. | HClO分子的结构式:H-O-Cl | D. | 四氯化碳分子比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 辣条是深受中小学生喜爱的小零食,并且已走出国门,畅销海外,右图是某品牌辣条产品标签的一部分.
辣条是深受中小学生喜爱的小零食,并且已走出国门,畅销海外,右图是某品牌辣条产品标签的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 37C l与39K的中子数不等 | B. | 12C与14C的质子数相等 | ||
| C. | H3O+与OH-的电子数相等 | D. | 15N2与14N2摩尔质量不等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取 |
| B | KNO3 | K2SO4 | Ba(NO3)2溶液,过滤 |
| C | Cu | CuO | 盐酸,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com