
| A.NH4Cl | B.KHSO4 | C.NaHCO3 | D.H2SO4 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:不详 题型:单选题
| A.c(SO42-)>c(NH4+)>c(Al3+)>c(OH-)>c(H+) |
| B.c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-) |
| C.c(NH4+)>c(SO42-)>c(Al3+)>c(OH-)>c(H+) |
| D.c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑥④②⑤ | B.③①④②⑥⑤ | C.③②①⑥②⑤ | D.⑤⑥②④①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
| C.CH3COONa溶液中:c(CH3COOH)+c(H+)=c(OH-) |
| D.Na2CO3溶液中:2c(Na+)=c(CO32- )+c(HCO3- )+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中水电离出的OH-的个数:②>① |
| B.溶液中阴离子的物质的量浓度之和:②>① |
| C.①溶液中:c(CO32-)<c(H2CO3) |
| D.②溶液中:c(HCO3-)<c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 化学式 | ①AgCl | ②AgBr | ③Ag2S | ④Ag2CrO4 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 2.0×10-48 | 2.0×10-12 |
| c(Br-) |
| c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
 SO2 +2Cu。
SO2 +2Cu。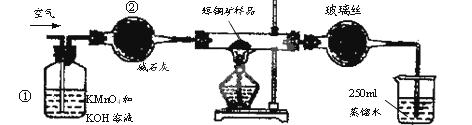
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com