
【题目】用惰性电极电解200mL KCl和CuSO4的混合溶液,经过一段时间后两极分别得到11.2L(标准状况下)气体。原混合溶液中KCl的物质的量浓度不可能为
A. 5mol/L B. 4mol/L C. 2.5mol/L D. 1mol/L
【答案】A
【解析】
用惰性电极电解200mL KCl和CuSO4混合溶液,溶液中阳离子放电顺序Cu2+>H+,阴离子放电顺序Cl->OH-,阳极电极反应为:2Cl--2e-=Cl2↑、4OH--4e- =2H2O+ O2↑,阴极电极反应为:Cu2++2e-=Cu、2H+ +2e- = H2↑,根据两极生成气体物质的量相等,若阳极上只产生Cl2时,Cl-的物质的量最大,据此分析。
用惰性电极电解200mL KCl和CuSO4的混合溶液,在两极均生成标准状况下的气体11.2L,由于阴极产生的气体只有氢气,则n(H2)=![]() =0.5mol,电解时阳极电极反应依次为:2Cl--2e-=Cl2↑、4OH--4e- =2H2O+ O2↑,若阳极上只产生Cl2时,Cl-的物质的量最大,此时,n(Cl2)=n(H2)=0.5mol,所以n(Cl-)<0.5mol×2=1mol,c(Cl-)<
=0.5mol,电解时阳极电极反应依次为:2Cl--2e-=Cl2↑、4OH--4e- =2H2O+ O2↑,若阳极上只产生Cl2时,Cl-的物质的量最大,此时,n(Cl2)=n(H2)=0.5mol,所以n(Cl-)<0.5mol×2=1mol,c(Cl-)<![]() =5mol·L-1。
=5mol·L-1。
故答案为A。


科目:高中化学 来源: 题型:
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()

A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中能用来区别SO2和CO2的是( )
①石灰水 ②紫色石蕊试液 ③氯水 ④品红溶液 ⑤酸性KMnO4
A. ③④⑤B. ①②③C. ①⑤D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
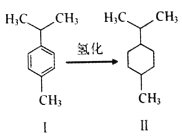
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④B. ②③C. ②④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g) ![]() N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g) ![]() N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:

①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g) ![]() 2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=________kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1molCO和2mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。

①该反应自发进行的条件是________(填“低温”、“高温”或“任意温度”)
②506K时,反应平衡时H2的转化率为________;压强:p1________(填“>”“<”或“=”)p2。
③反应速率:N点v正(CO)________(填“>”“<”或“=”)M点v逆(CO)。
(4)已知常温下,H2A在水中存在以下平衡:H2A![]() H++HA﹣,HA﹣
H++HA﹣,HA﹣![]() H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0。
H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需要配制500 mL 1 mol·L-1硫酸溶液。
(1)需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸________mL。
有如下操作步骤:
①把量好的浓硫酸沿烧杯壁慢慢注入蒸馏水中,并用玻璃棒搅拌溶解。
②把①所得溶液冷却后小心转入500mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(2)操作步骤的正确顺序为______________(填序号)。
(3)本实验必须用到的玻璃仪器有10ml量筒、玻璃棒、烧杯、_________。
(4)下列情况使所配溶液的浓度偏高的是_________
A.某同学观察液面的情况如图所示

B.没有进行操作步骤④;
C.加蒸馏水时不慎超过了刻度线,再吸出一部分水。
D.向容量瓶中转移溶液时(操作步骤②)溶液流到容量瓶外面
(5)若实验过程中出现(4)中D选项情况应如何处理?:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展可以促进社会进步:
(1)玻璃是常见的硅酸盐产品,制玻璃发生的主要反应为_________,__________。
(2)钢化玻璃是一种常见的玻璃产品,其主要成分为_______________。
我们看到的玻璃,一般都呈淡绿色,只是因为原料中混有____________。
(3)插座也是一种塑料,它有绝缘性好,耐热,抗水等优点。它属于热____性塑料。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com