
| A. | 2:3 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
分析 Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl中,Cl元素的化合价降低得到电子被还原,S元素的化合价升高失去电子被氧化,结合电子及原子守恒计算.
解答 解:Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl中,S元素的化合价升高失去电子被氧化,则H2SO4为氧化产物,Cl元素的化合价降低得到电子被还原,则NaCl、HCl为还原产物,由反应可知,生成1mol氧化产物时,得到2mol还原产物,则氧化产物与还原产物的物质的量之比为1:2,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:推断题
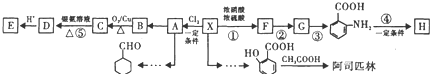
[化学——选修5:有机化学基础]抗疟新药青蒿素的结构简式如下图所示。
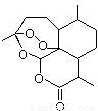
(1)青蒿素的分子式为____。
(2)为了引入过氧基(-O-O-),需要在有机合成中引入羟基,引入羟基的反应类型有____。(选填编号)
①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤还原反应
天然香草醛(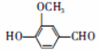 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图:
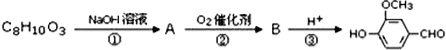
(3)M的结构简式为____。
(4)步骤①③的作用是____。
(5)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的结构简式____。
①苯环二取代;②能水解;③能发生银镜反应;④与FeCl3溶液发生显色反应。
(6)苄基乙醛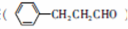 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
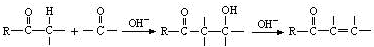
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
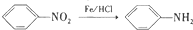 (苯胺、易被氧化)
(苯胺、易被氧化)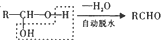
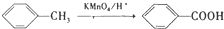
 ;
;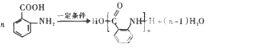 ;
;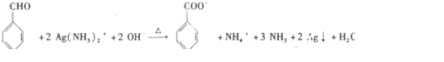 .
.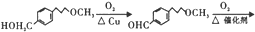 完成
完成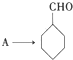 的流程图
的流程图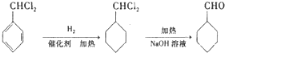 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
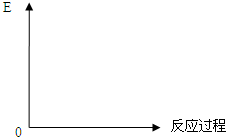 Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>C(OH-) | |
| C. | 氯气溶于水达到平衡后,若其他条件不变加入CaCO3固体,$\frac{c({H}^{+})}{c(HClO)}$增加 | |
| D. | NaSiO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完反应,放出的热量为28.7 kJ | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 | |
| D. | 2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则碳的燃烧热等于 110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
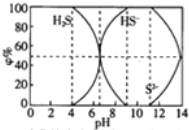
| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 1.81mol | C. | 2.5mol | D. | 3.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com