
 )
) 2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________
2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________ 部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的____倍
部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____(填“空气”或“天然气”)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3的基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的____倍科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (2)2Zn(s)+O2(g)=2ZnO(s) Δ
(2)2Zn(s)+O2(g)=2ZnO(s) Δ H1 =" —702" kJ/mol
H1 =" —702" kJ/mol 2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
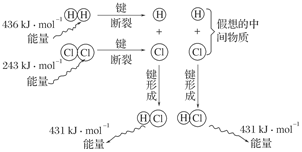
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
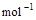 ,
,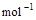 。
。| A. 0.4Q1+0.05Q3 | B.0.4Q1+0.05Q2 | C.0.4Q1+0.1Q3 | D.0.4Q1+0.2Q2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
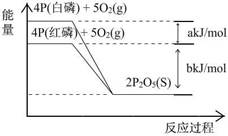
| A.4P(白磷) + 5O2(g) = 2P2O5(S) ; △H1= +(a+b) kJ/mol |
| B.4P(红磷) + 5O2(g) = 2P2O5(S) ; △H2= -(b)kJ/mol |
| C.4P + 5O2= 2P2O5(S) ; △H3= +(a+b) kJ/mol |
| D.P(白磷) = P(红磷) ; △H4= +(a)kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.43kJ | B.4.86kJ | C.43.8kJ | D.87.5 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.ΔH3=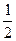 (ΔH1+ΔH2) (ΔH1+ΔH2) | B.ΔH3=ΔH2-ΔH1 |
| C.ΔH3=2(ΔH2+ΔH1) | D.ΔH3=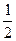 (ΔH2-ΔH1) (ΔH2-ΔH1) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com