
【题目】实验室做乙醛和银氨溶液发生银镜反应的实验时:
(1)为产生光亮的银镜,试管应先用______溶液煮沸,倒掉煮沸液后再用清水将试管冲洗干净。
(2)配制银氨溶液时向盛有__________溶液的试管中逐滴滴加__________溶液边滴边振荡直到__________为止。有关化学反应的离子方程式为:①_____________________;②_________________________。
(3)加热时应用________加热,产生银镜的化学方程式:____________________。
(4)实验室配制银氨溶液时若向AgNO 3 溶液中加入氨水形成银氨溶液时,应防止加入氨水过量,否则容易生成容易爆炸的________,试剂本身也失去灵敏性。配制好的银氨溶液不可久置,否则会生成________,从溶液中析出这种沉淀,哪怕是用玻璃棒刮擦也会分解发生猛烈的爆炸。
【答案】 NaOH AgNO3 氨水 先生成的沉淀恰好溶解 Ag+ +NH3 H2 O=AgOH↓+NH4+ AgOH+2NH3 H2 O =[Ag(NH3)2 ]+ +OH- +2H2O 水浴 CH3CHO+2[Ag(NH3)2]OH![]() CH3COONH4 +3NH3↑+2Ag↓+H2O Ag3N Ag2NH
CH3COONH4 +3NH3↑+2Ag↓+H2O Ag3N Ag2NH
【解析】
(1)欲使银镜反应实验成功必须用NaOH溶液煮沸试管以除去油污,以免析出的银难以附着在试管上;
(2)银氨溶液的配制:取1mL 2%的AgNO3溶液于洁净的试管中,然后边振荡试管边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止,制得银氨溶液,配制银氨溶液时,一定注意不要溶液滴加到氨水中,应把氨水滴加到AgNO3溶液中,有关化学反应的离子方程式为:①Ag+ +NH3 H2 O=AgOH↓+NH4+ ;②AgOH+2NH3 H2 O =[Ag(NH3)2 ]+ +OH- +2H2O;
(3) 为了受热均匀,采用水浴加热,产生银镜的化学方程式:CH3CHO+2[Ag(NH3)2]OH![]() CH3COONH4 +3NH3↑+2Ag↓+H2O;
CH3COONH4 +3NH3↑+2Ag↓+H2O;
(4)在配制银氨溶液时一定要注意向AgNO3溶液中逐滴加入氨水,并且要一边摇动试管一边滴加,直至沉淀刚刚消失为止,就得到无色的银氨溶液,一定要注意控制氨水的量,否则容易生成容易爆炸的氮化银(Ag3N)。而且银氨溶液必须要现配现用,否则会生成亚氨基化银(Ag2NH)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
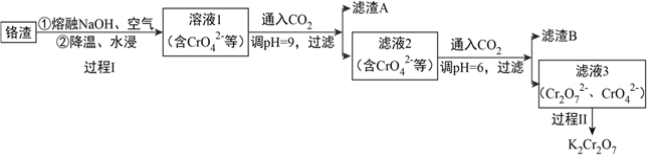
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,A与E同主族,E的单质是良好的半导体材料,D+核外电子排布与C2-相同。试回答(涉及到的物质均用化学式作答):
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是____________(写一个即可)。
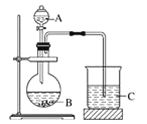
(3)A、B和E最高价氧化物对应的水化物中,酸性最弱的是_________________(写化学式)。若用如图中装置验证这三种酸的酸性强弱,则在装置A中应加入______(写化学式),烧杯C观察到的实验现象是_____________________________。该实验装置存在不足,影响到实验目的的达成,改进方法是_____________。
(4)B的最高价氧化物对应的水化物的稀溶液与B的气态氢化物反应的化学方程式为_____________
(5)用电子式表示D2C的形成过程:_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明硅酸的酸性弱于碳酸的实验事实是
A. CO2溶于水形成碳酸,SiO2难溶于水
B. CO2通入可溶性硅酸盐溶液中析出硅酸沉淀
C. 高温下SiO2与碳酸盐反应生成CO2
D. 氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程,属于吸热反应的是( )
①碳与水蒸气反应 ②将胆矾加热变为白色粉末 ③浓H2SO4稀释 ④氯化铵晶体溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)28H2O混合搅拌 ⑧碳酸钙热分解.
A. ①②④⑥⑦⑧ B. ①②⑥⑦ C. ④⑥⑦⑧ D. ①②⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型示意图。下列说法正确的是( )
A.  能使酸性高锰酸钾溶液褪色
能使酸性高锰酸钾溶液褪色
B. ![]() 可与溴水发生取代反应使溴水褪色
可与溴水发生取代反应使溴水褪色
C.  中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D. ![]() 在稀硫酸作用下可与乙酸发生取代反应
在稀硫酸作用下可与乙酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将稀硫酸和碳酸钠反应生成的气体通入一定浓度的硅酸钠溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4 >H2CO3> H2SiO3 |
B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
C | 加热盛有氯化铵固体的试管 | 试管底部固体消失,试管口有晶体凝结 | 氯化铵固体可以升华 |
D | 向硫酸铜溶液中通入氯化氢气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸的酸性比硫酸强 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①CH4、②C2H2、③C2H4、④C2H6、⑤苯中
(1)能使酸性高锰酸钾溶液褪色的是__________。(填序号,下同)
(2)相同物质的量,在氧气中完全燃烧时消耗氧气最多的是________;
(3)相同质量,在氧气中完全燃烧时消耗氧气最多的是____,耗氧量、生成CO2和水都相等的是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com