
下列溶液,一定呈中性的是( )
|
| A. | c(H+)=1×10﹣7mol/L的溶液 |
|
| B. | pH=pOH 的溶液 |
|
| C. | pH=14﹣pOH 的溶液 |
|
| D. | 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
考点:
溶液pH的定义.
专题:
电离平衡与溶液的pH专题.
分析:
溶液的酸碱性是根据溶液中H+浓度与OH﹣浓度的相对大小判断.
当c(H+)>c(OH﹣),溶液就呈酸性;
当c(H+)=c(OH﹣),溶液就呈中性;
当溶液中c(H+)<c(OH﹣),溶液就呈碱性;据此即可解答.
解答:
解:A.常温下,水的离子积Kw=1×10﹣14,所以,c(H+)<1×10﹣7mol/L,溶液呈酸性;c(H+)=1×10﹣7mol/L,溶液呈中性;c(H+)>1×10﹣7mol/L,溶液呈碱性.Kw受温度影响,水的电离是吸热的,温度越高Kw越大,如100℃时,水的离子积常数是10﹣12,当c(H+)=1×10﹣6mol/L时溶液呈中性,当c(H+)=1×10﹣7mol/L时溶液呈碱性,该选项中c(H+)=1×10﹣7mol/L的溶液,也可能显碱性,故A错误;
B.溶液中当C(H+)=C(OH﹣)时,溶液一定呈中性,pH=﹣lg〔H+〕,pOH=﹣lg〔OH﹣),pH=pOH,故B正确;
C.pH=14﹣pOH,pH+pOH=14,根据 pH=﹣lg〔H+〕,pOH=﹣lg〔OH﹣),可知:c(H+)×c(OH﹣)=1×10﹣14,当c(H+)=1×10﹣6mol/L,c(OH﹣)=1×10﹣8mol/L,符合条件,但c(H+)>c(OH﹣),溶液呈酸性,故C错误;
D.由等体积、等物质的量浓度的醋酸和氢氧化钠混合,醋酸和氢氧化钠恰好反应生成乙酸钠和水,乙酸钠是弱酸强碱盐水解而使溶液呈碱性,故D错误;
故选B.
点评:
本题主要考查溶液的酸碱性的判断,注意根据氢离子浓度和氢氧根离子浓度的相对大小判断溶液的酸碱性,注意酸碱电解质的强弱以及盐类水解的酸碱性是关键,题目不难.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
若某装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+═Cu2++H2↑,则下列关于该装置的有关说法中正确的是()
A. 该装置可能是原电池,也可能是电解池
B. 该装置只能是原电池,且电解质溶液为硝酸
C. 该装置只能是电解池,且金属铜为该电解池的阳极
D. 该装置只能是原电池,电解质溶液不可能是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
向某溶液中缓缓通入Cl2至过量,此过程中一直未观察到有沉淀生成,该溶液中可能大量共存的离子组是()
A. CO32﹣、SO42﹣、K+、Na+ B. Ag+、NO3﹣、Cu2+、Na+
C. SO2、Ba2+、Cl﹣、K+ D. AlO2﹣、Br﹣、Na+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应N2+O2⇌2NO在密闭容器中进行,下列哪个条件不能加快化学反应速率( )
|
| A. | 缩小体积使压强增大 |
|
| B. | 体积不变充入N2使压强增大 |
|
| C. | 体积不变充入 He使压强增大 |
|
| D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S的水溶液洗患处可以用来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好.请说明原因,并写出有关的离子方程式.(已知:H2S有毒,可杀虫)
(1)可治疗的原因
(2)热水配制的原因 .
(3)离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)( )
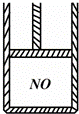
|
| A. | 等于1.369g•L﹣1 |
|
| B. | 等于2.054g•L﹣1 |
|
| C. | 在1.369g•L﹣1和2.054g•L﹣1之间 |
|
| D. | 在2.054g•L﹣1和4.108g•L﹣1之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生如下反应:2KClO3+I2=2KIO3+Cl2,则下列推断正确的是()
A. 该反应属于置换反应
B. 该反应中氧化剂为I2
C. 该反应中还原剂为KClO3
D. 该反应中KClO3被还原为Cl2,I2被氧化为KIO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com