
分析 根据n=$\frac{m}{M}$计算32gN2H4的物质的量,再根据热化学方程式书写原则书写热化学方程式.
解答 解:32gN2H4的物质的量为$\frac{32g}{32g/mol}$=1mol,与二氧化氮反应生成氮气与气态水放出568kJ的热量,热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ•mol-1;
故答案为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ•mol-1.
点评 考查热化学方程式的书写、反应热的有关计算等,难度不大,这部分的试题要注意理解盖斯定律的内涵并灵活应用.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
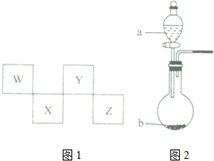 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物. ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 3:3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
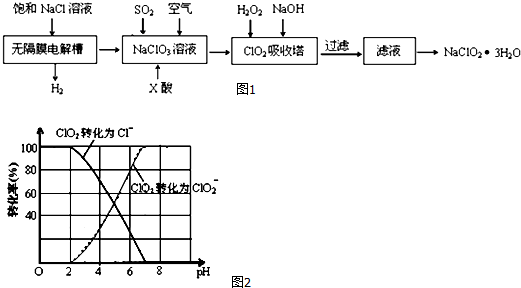
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| A | B | C | D | |
| 物质 | 煤油 | 丙醇 | 四氯化碳 | 乙醚 |
| 沸点/℃ | 180~310℃ | 97.4 | 76.5 | 34.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| D. | C2H5OH(CH3COOH),加足量CaO,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(X-) | C. | $\frac{c({H}^{+})}{c(HX)}$ | D. | $\frac{c(HX)}{c({H}^{+})}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com