
| A. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl 溶液、④(NH4)2Fe(SO4)2溶液中,c(${NH}_{4}^{+}$)的大小关系:④>①>②>③ | |
| C. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | 物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(${HCO}_{3}^{-}$)+c(${CO}_{3}^{2-}$) |
分析 A.由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,一水合氨的电离程度减小;
B.(NH4)2SO4、(NH4)2Fe(SO4)2的化学式中含有2个铵根离子,且亚铁离子抑制了铵根离子的水解,则(NH4)2Fe(SO4)2溶液中铵根离子浓度最大,其次为(NH4)2SO4,碳酸氢根离子促进了铵根离子的水解,则四种溶液中,NH4HCO3溶液中铵根离子浓度最小;
C.反应后溶液中溶质为等浓度的HA和NaA,混合液pH大于7,说明A-的水解程度大于HA的电离程度,则c(HA)>c(A-),再结合物料守恒可得c(HA)>c(Na+)>c(A-);
D.根据次氯酸钠、碳酸氢钠溶液中的物料守恒判断.
解答 解:A.由于(NH4)2SO4=2NH4++SO42-导致溶液中NH4+浓度增大,抑制氨水的电离,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故A错误;
B.浓度相同的四种溶液中,(NH4)2SO4、(NH4)2Fe(SO4)2的化学式中含有2个铵根离子,且亚铁离子抑制了铵根离子的水解,则(NH4)2Fe(SO4)2溶液中c(NH4+)最大,其次为(NH4)2SO4,碳酸氢根离子促进了NH4+的水解,则四种溶液中,NH4HCO3溶液中c(NH4+)最小,所以c(NH4+)的大小关系为:④>①>③>②,故B错误;
C.将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶质为等浓度的HA和NaA,混合液pH大于7,说明A-的水解程度大于HA的电离程度,则c(HA)>c(A-),根据物料守恒c(A-)+c(HA)=2c(Na+)可知:c(HA)>c(Na+)>c(A-),故C正确;
D.物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中,根据物料守恒可得:c(HClO)+c(ClO-)=c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故D错误;
故选C.
点评 本题考查离子浓度大小比较、盐的水解原理及其应用等知识,题目难度中等,在判断能水解的盐溶液中离子浓度大小时,要注意把握影响盐类水解的外界条件,把握弱电解质的电离特征及其影响因素.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 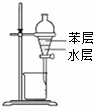 用图所示装置分离苯和水 | |
| B. | 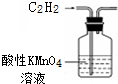 用图所示装置除去C2H2中含有的少量H2S | |
| C. | 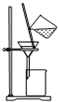 用图所示装置分离NaCl和CaCl2的混合溶液 | |
| D. | 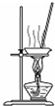 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质Se在空气中燃烧可生成SeO2 | B. | Se的原子序数为24 | ||
| C. | 可形成Na2SeO3、Na2SeO4两种盐 | D. | H2S比H2Se稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>H2S>HF | |
| B. | 微粒X2-和Y2+的核外电子排布相同,离子半径:X2-<Y2+ | |
| C. | 第3周期金属都能与氯气发生化合反应 | |
| D. | 第IVA族元素的氧化物都能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液中加入过量氨水得到深蓝色溶液:Cu2++2OH-═Cu(OH)2↓ | |
| B. | 碳酸钠溶液中滴入酚酞试液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | FeCl2溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| D. | 90℃时,测得纯水pH=6.7,pH<7的原因是:H2O(l)?H+(aq)+OH-(aq)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
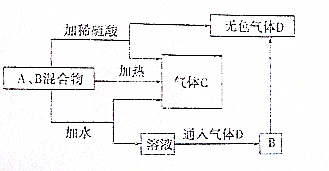 有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题:
有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题:查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:实验题
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。
① 甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
② 乙直接加热饱和FeCl3溶液。
③ 丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法更合理: ,可以利用胶体的什么性质来证明有Fe(OH)3胶体生成? 。
(2)Fe(OH)3胶体稳定存在的主要原因是_________________。
A.胶粒直径小于1 nm B.胶粒带正电荷 C.胶粒作布朗运动 D.胶粒能透过滤纸
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是____________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间 B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系 D.Fe(OH)3胶体的分散质能透过滤纸
(4)提纯所制Fe(OH)3胶体常用的方法是________,若 向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。
向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com