
实验测得CO2为共价化合物,两个C=O键间的夹角为180°,以下判断正确的是
A.由极性键构成的极性分子 B.由极性键构成的非极性分子
C.由非极性键构成的极性分子 D.CO2中C采取sp2杂化
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015江苏省宿迁市三校高一下学期4月月考化学试卷(解析版) 题型:选择题
银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪。制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了。“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是
A.硫的还原性 B.硫的漂白性
C.二氧化硫的还原性 D.二氧化硫的漂白性
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高一下学期第一次联考化学试卷(解析版) 题型:选择题
反应3Cl2+8NH3=6NH4Cl+N2中,如果有0.6mol电子转移,则被氧化的氨的质量是
A.3.4g B.6.8g C.10.2g D.27.2g
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:填空题
(9分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D <E。其中A、B、C是同一周期的非金属元素,AC2为非极性分子。D单质与水形成的溶液具有漂白性。E的原子序数为24,ED3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)已知A、D形成的化合物分子空间构型为正四面体,而光气(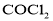 )分子空间构型为平面三角形,说明原因 。光气(
)分子空间构型为平面三角形,说明原因 。光气( )分子中碳氧原子间的共价键的键型是 (填序号)。
)分子中碳氧原子间的共价键的键型是 (填序号)。
A.1个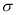 键 B.2
键 B.2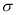 个键
个键
C.2个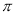 键 D.1个
键 D.1个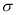 键,1个
键,1个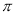 键
键
(3)写出等物质的量的D单质和SO2气体同时通入水中反应的离子方程式 。
(4)ED3与B、C的氢化物形成的配合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
在物质结构研究的历史上,首先提出原子内有电子学说的科学家是
A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:选择题
已知 2Fe3+ +2I- =2Fe2+ +I2 2Fe2+ +Cl2 =2Fe3+ +2Cl-
则有关离子的还原性由强到弱的顺序为
A.Cl->Fe2+>I- B.I->Fe2+>Cl-
C.Fe2+>I->Cl- D.Fe2+>Cl->I-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:选择题
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ ===2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B.实验②能说明氧化性:Cr2O72- > Fe3+
C.CrO42-和Fe2+在酸性溶液中可以大量共存
D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com