
科学家利用太阳能分解水生成的氢气在催化剂作用下与CO2反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJ/mol、﹣283.0kJ/mol和﹣726.5kJ/mol,请回答下列问题:
(1)用太阳能分解5mol水消耗的能量是 kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(3)已知25℃、101kPa下,H2O(l)═H2O(g)△H=+44kJ•mol﹣1.则1g甲醇(CH3OH)燃烧 生成CO2和气态水时放出的热量为 .
生成CO2和气态水时放出的热量为 .
考点: 有关反应热的计算;热化学方程式.
专题: 化学反应中的能量变化.
分析: (1)根据氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)1mol液态水变成气态水需吸热44KJ,结合CH3OH(l)的燃烧热△H为﹣726.5kJ/mol求解,气态水时放出的热量少;
解答: 解:(1)由H2(g)的燃烧热△H为﹣285.8kJ•mol﹣1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,
即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解5mol H2O(l)消耗的能量为285.8kJ×5=1429kJ,
故答案为:1429;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为﹣283.0kJ•mol﹣1和﹣726.5kJ•mol﹣1,则
①CO(g)+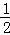 O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1
O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1
②CH3OH(l)+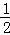 O2(g)=CO2(g)+2 H2O(l)△H=﹣726.5kJ•mol﹣1
O2(g)=CO2(g)+2 H2O(l)△H=﹣726.5kJ•mol﹣1
由盖斯定律可知,②﹣①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则△H=﹣ 726.5kJ•mol﹣1﹣(﹣283.0kJ•mol﹣1)=﹣443.5kJ•mol﹣1,
726.5kJ•mol﹣1﹣(﹣283.0kJ•mol﹣1)=﹣443.5kJ•mol﹣1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=﹣443.5kJ•mol﹣1;
(3)CH3OH(l)的燃烧热△H为﹣726.5kJ/mol,热化学方程式为CH3OH(g)+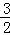 O2(g)=CO2(g)+2H2O(l);△H=﹣726.5kJ/mol,1mol液态水变成气态水需吸热44KJ,若2mol液态水变成水蒸气时则吸热88KJ,热化学方程式为CH3OH(g)+
O2(g)=CO2(g)+2H2O(l);△H=﹣726.5kJ/mol,1mol液态水变成气态水需吸热44KJ,若2mol液态水变成水蒸气时则吸热88KJ,热化学方程式为CH3OH(g)+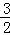 O2(g)=CO2(g)+2H2O(g);△H=﹣(726.5﹣88)kJ/mol=﹣638.5kJ/mol,则1g甲醇(CH3OH)燃烧生成CO2和气态水时放出的热量为
O2(g)=CO2(g)+2H2O(g);△H=﹣(726.5﹣88)kJ/mol=﹣638.5kJ/mol,则1g甲醇(CH3OH)燃烧生成CO2和气态水时放出的热量为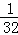 ×638.5kJ≈19.95KJ,
×638.5kJ≈19.95KJ,
故答案为:19.95KJ;
点评: 本题考查反应热的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意若为放热反应,则△H为“﹣”;若为吸热反应,则△H为“+”.对于同一反应来说,计量系数不同,△H不同,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)()
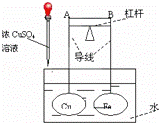
A. 杠杆为导体和绝缘体时,均为A端高,B端低
B. 杠杆为导体和绝缘体时,均为A端低,B端高
C. 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D. 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子 中活化分子的百分数
中活化分子的百分数
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
火电厂利用燃煤发电,煤燃烧中的热化学方程式有:C(s)+O2(g)═CO2(g)△H1=﹣393.5kJ/molCO(g)+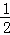 O2(g)═CO2(g)△H2=﹣283kJ/mol C(s)+
O2(g)═CO2(g)△H2=﹣283kJ/mol C(s)+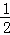 O2(g)═CO(g)△H3=?下列有关说法中不正确的是()
O2(g)═CO(g)△H3=?下列有关说法中不正确的是()
A. CO的燃烧热为283 kJ/mol
B. 二氧化碳分解为一氧化碳和氧气的反应是吸热反应
C. △H3=△H2﹣△H1=110.5 kJ/mol
D. △H3=△H1﹣△H2=﹣110.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列正确的是()
甲.在500℃时,SO2和O2各10mol反应
乙.在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙.在450℃时,8mol SO2和5mol O2反应
丁.在500℃时,8mol SO2和5mol O2反应.
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁 C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H=+131.3kJ/mol表示()
CO(g)+H2(g);△H=+131.3kJ/mol表示()
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有热化学方程式:SO2(g)+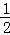 O2(g)═SO3(g)△H=﹣98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于()
O2(g)═SO3(g)△H=﹣98.32kJ/mol现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于()
A. 40% B. 50% C. 70% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)⇌2HI(g)△H<0反应中各物质的浓度随时间变化情况如图1:
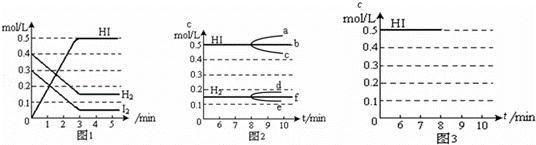
(1)该反应的化学平衡常数表达式为K= .
(2)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写“增大”、“减小”或“不变”)HI浓度的变化正确的是 (用图2中a﹣c的编号回答)
②若加入I2,H2浓度的变化正确的是 ,(用图2中d﹣f的编号回答)
(3)反应达到平衡后,第8分钟时,若反应容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况.
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里做钠跟水反应的实验时,用到的仪器和药品是()
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙.
A. ①②③④ B. ②③④⑥⑨ C. ③④⑧⑨⑩ D. ②⑤⑦⑨⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com