
有Na2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.4 mol/L,SO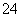 的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为 ( )
的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为 ( )
A.0.1 mol/L B.0.15 mol/L
C.0.2 mol/L D.0.25 mol/L
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______,电子数为________。
(2)硅主要以硅酸盐、________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/(kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是______________________________________________。
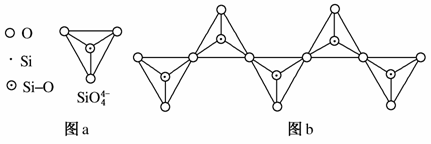
(6)在硅酸盐中,SiO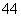 四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2
表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为(  )
)
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2的分解反应为COCl2(g)===Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min 的COCl2浓度变化曲线未示出):
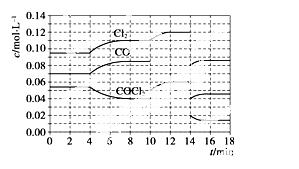
①计算反应在第8 min时的平衡常数K=____________;
②比较第2 min反应温 度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
③若12 min时反应于 温度T(8)下重新达到平衡,则此时c(COCl2)=________
温度T(8)下重新达到平衡,则此时c(COCl2)=________
mol·L-1;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示] 的大小____________________________;
的大小____________________________;
⑤比较反应物COCl2在5~6 min和 15~16 min时平均反应速率的大小:v(5~6)________v(15~16)(填“<”、“>”或“=”),原因是______________________。
15~16 min时平均反应速率的大小:v(5~6)________v(15~16)(填“<”、“>”或“=”),原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两物质的溶解度曲线如图所示.下列叙述中,正确的是  ( )
( )
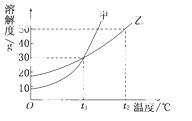 A.t1℃时
A.t1℃时 ,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
B.t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,
甲先达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
有硫酸镁溶液500ml,它的密度为1.20g/cm3,其中镁离子的质量分数为4.8%,则有关该溶液的说法不正确的是 ( )
A.溶质的质量分数为24.0%
B.溶液的物质的量浓度为2.4mol/L
C.溶质和溶剂的物质的量之比为1:40
D.硫酸根离子的质量分数为19.2 %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
v L Fe2(SO4)3溶液中含有a g SO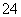 ,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
A.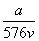 mol·L-1 B.
mol·L-1 B.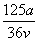 mol·L-1
mol·L-1
C.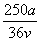 mol·L-1 D.
mol·L-1 D.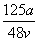 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下:
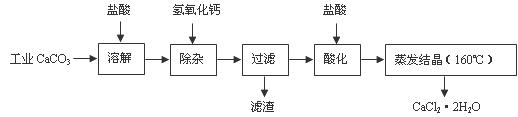
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0-8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①
;② 。
(3)测定样品中Cl- 含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①计算上述样品中CaCl2·2H2O的质量分数为 。
②若用上述办法测定的样品中CaCl2·2H2O的质量分数有时超过100.0%(测定过程中产生的误差可忽略),其可能原因有
查看答案和解析>>
科目:高中化学 来源: 题型:
石灰石的分解反应为:CaCO3(s)==CaO(s) +CO2(g)
其△H(298K)==178.2kJ·mol—1,△S(298K)== 169.6J·mol—1·K—1
169.6J·mol—1·K—1
试根据以上数据判断该反应在常温下是否自发进行?其分解温度是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com