
| A. | 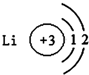 | B. | 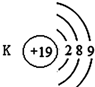 | C. | 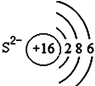 | D. | 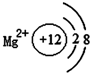 |
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为:Zn-2e-=Zn2+ | ||
| C. | 正极发生氧化反应 | D. | 正极反应为:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 无论怎样控制反应条件,2 mol SO2与1 mol O2 反应时都不会生成2 mol SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CH4 的电极为正极 | |
| B. | 正极的电极反应式为:2O2+8e-+4H2O═8OH- | |
| C. | 若甲烷通入量为1.12 L(标准状况)且反应完全,则电池中有0.1 mol O2 被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+2O2+4e-═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
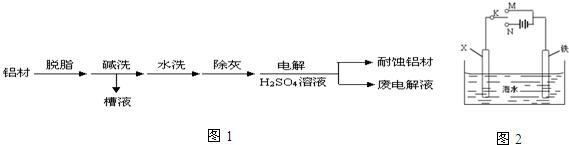
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 单位时间内消耗0.1mol X,同时生成0.2mol Y | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润 | |
| B. | 容量瓶用蒸馏水洗净、必须烘干后才能用于溶液的配制 | |
| C. | 用苯萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出 | |
| D. | 中和滴定时,锥形瓶不需要用待测液润洗后就能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
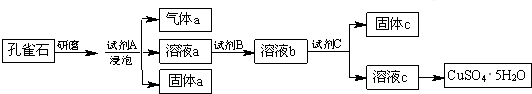
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2常用于自来水消毒 | |
| B. | SO2常用于漂白食品 | |
| C. | SiO2常用于制造光导纤维 | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com