
����Ŀ����ˮ�й����İ���(NH3��NH4+)�ᵼ��ˮ�帻Ӫ������ij����С����NaClO����������������ˮ����֪����HClO�������Ա�NaClOǿ����NH3��NH4+���ױ��������۹��ұ�Ҫ�������İ�����ˮpHҪ������6��9��
(1)pH��1.25ʱ��NaClO����NH4+��Ӧ����N2������Ⱦ���ʣ��÷�Ӧ�����ӷ���ʽΪ_____��
(2)��ˮpH����ȥ���ʺͳ�ˮpH��Ӱ������ͼ��ʾ

�ٽ�ˮpHΪ1.25��2.75��Χ�ڣ�����ȥ������pH����Ѹ���½���ԭ����_____
�ڽ�ˮpHΪ2.75��6.00��Χ�ڣ�����ȥ������pH���߶�������ԭ����_____
�۽�ˮpHӦ������_____����Ϊ�ˡ�
(3)Ϊ�о�������NaClO����������Ӱ�죬�����������䣬�����ӵ�λʱ����ͨ��������������ְ���ȥ���ʼ������䡣��ԭ�������_____(����ĸ)��
a��O2�������Ա�NaClO�� b��O2�����������ʱ�NaClO��
c��O2����Һ���ܽ�ȱȽ�С d�������е�N2������Һ��
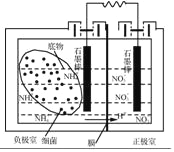
(4)��������ȼ�ϵ�ؿ��Զ�����ˮ���д�������װ����ͼ��ʾ���պϵ�·�������������Ҿ�����������������NH4+������Ӧ�ĵ缫��ӦʽΪ_____����װ�ó����ܶ�����ˮ���д����⣬��һ��ͻ�����ŵ���_____��
���𰸡�3ClO����2NH4+===N2����3Cl����3H2O��2H��(��3HClO��2NH4+===N2����3Cl����3H2O��5H��) ����pH���ߣ�NaClO���������������ܽ��ͣ����°���ȥ�����½� ����pH���ߣ�������ˮ��NH3�������������ױ����� 1.50 abc 2NH4+��6e��===N2����8H�� ����ѧ��ת��Ϊ����(���ܴ�����̬����ˮ)
��������
��1����Ԫ�ػή�͵�-1�ۣ��ٸ���������ԭ��Ӧ������ƽ��д���ӷ���ʽ��
��2����ϸ�������֪��Ϣ����Һ����֮��Ĺ�ϵ��ͼ��仯��������
��3���ӿ����е����������������������ؿ��ǣ�
��4������ԭ���ԭ����������笠�����ʧ���ӷ���������Ӧ���ܷ�Ӧ����ѧ��ת��Ϊ���ܡ�
��1��pH��1.25ʱ��NaClO��Һ�������ԣ���Һ�л��д����ᣬ������NH![]() ��Ӧ����N2�������Ӻ������ӣ������ӷ���ʽΪ��3ClO����2NH4+===N2����3Cl����3H2O��2H������3HClO��2NH4+===N2����3Cl����3H2O��5H������
��Ӧ����N2�������Ӻ������ӣ������ӷ���ʽΪ��3ClO����2NH4+===N2����3Cl����3H2O��2H������3HClO��2NH4+===N2����3Cl����3H2O��5H������
�ʴ�Ϊ��3ClO����2NH4+===N2����3Cl����3H2O��2H������3HClO��2NH4+===N2����3Cl����3H2O��5H������
��2����HClO�������Ա�NaClOǿ����ˮpHΪ1.25��2.75��Χ�ڣ���pH���ߣ�HClO������Խ��ͣ���NaClO�������������������ܽ��ͣ����°���ȥ�����½���
�ʴ�Ϊ������pH���ߣ�NaClO���������������ܽ��ͣ����°���ȥ�����½���
�ڽ�ˮpHΪ2.75��6.00��Χ�ڣ���pH���ߣ��ٽ�笠�����ˮ�⣬ʹ�����ɷ�����笠�����Ũ�Ƚ��ͣ����ݸ�����Ϣ����֪��NH3��NH![]() ���ױ��������ʵ��°���ȥ�������ߣ�
���ױ��������ʵ��°���ȥ�������ߣ�
�ʴ�Ϊ������pH���ߣ�������ˮ��NH3�������������ױ�������
�۰��չ��ұ�Ҫ���������İ�����ˮpHҪ������6��9����Ͻ�ˮpH�Գ�ˮpH��Ӱ�����߿�֪������ˮpHҪ������6��9�����ˮpHΪ1.5-2.1���ٸ��ݽ�ˮpH1.25��2.75��Χ�ڶ���ȥ���ʵ�Ӱ���ۺϿ��ǣ���ѡ���ˮpHӦ������1.50����Ϊ�ˣ�
�ʴ�Ϊ��1.50��
��3�������ӵ�λʱ����ͨ��������������ְ���ȥ���ʼ������䣬��������ΪO2�������Ա�NaClO����O2�����������ʱ�NaClO����O2����Һ���ܽ�ȱȽ�С����abc����ȷ��������������ˮ��d��˵������
�ʴ�Ϊ��abc��
��4������ԭ���ԭ����ϵ������ҺΪ���ӽ���Ĥ������笠�����ʧ�������ɵ���������������Ӧ����缫��ӦʽΪ��2NH4+��6e��===N2����8H��������������ԭ��ӦҲ���ɵ������ﵽ������ˮ���д�����Ŀ�ģ��һ��ܽ���ѧ��ת��Ϊ���ܣ��Ǹ�ȼ�ϵ��װ��ͻ�����ŵ㣬
�ʴ�Ϊ��2NH4+��6e��===N2����8H��������ѧ��ת��Ϊ����(���ܴ�����̬����ˮ)



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵������ȷ����
A. �Ҵ����Ҷ�����Ϊͬϵ��
B. ������ϩ��ʹ��ˮ��ɫ
C. ��֬�ڼ��������µ�ˮ�ⷴӦ�ֳ�Ϊ������Ӧ
D. ��(33��(![]() )��һ�ȴ��ﹲ��3��(���������칹)
)��һ�ȴ��ﹲ��3��(���������칹)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X�����ںϳ�Y�������й�X��Y��˵����ȷ����(����)
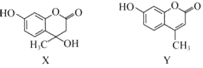
A. X����������ԭ�ӿ�����ͬһƽ����
B. X��һ�������¿��Է�����ȥ��Ӧ
C. Y������H2�ļӳɲ����в�������̼ԭ��
D. X��Y������Ũ��ˮ��Ӧ��������ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�����ʵ����ʵ���Ũ��Ϊ1 mol/L���ǣ� ��
A. ��40gNaOH��������1Lˮ��
B. ��22.4 L�Ȼ�����������ˮ���1L��Һ
C. ��1L 10mol/L��Ũ������9Lˮ���
D. ��10g NaOH�����ܽ���ˮ�����250 mL��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�Ǻϳ���ά���ϳ����ϳ����ϡ��ϳ��Ҵ��Ļ�������ԭ�ϡ��ش��������⣺
��1��ʵ���ҿ�����ȡ������ϩ������ϩ����![]() ����NaOH��Һ��Ӧ��ȡ��д���÷�Ӧ�Ļ�ѧ����ʽΪ________����ת��Ϊ�������Σ���
����NaOH��Һ��Ӧ��ȡ��д���÷�Ӧ�Ļ�ѧ����ʽΪ________����ת��Ϊ�������Σ���
��2�������ѽ��Ʊ���ϩԽ��Խ�ܵ�ʯ����ҵ�����ӡ���֪�����Ȼ�ѧ����ʽ���£�
��C2H6��g��=C2H4��g����H2��g�� ��H1����137kJ��mol��1
��CO2��g����H2��g��=CO��g����H2O��g�� ��H2����42kJ��mol��1
��C2H6��g����CO2��g��=C2H4��g����CO��g����H2O��g�� ��H3
�ٷ�Ӧ��ġ�H3��________kJ��mol��1��
������1273Kʱ��100kPa�·�Ӧ���ﵽƽ��ʱ�����������C2H4��C2H6��H2�����ʵ����ֱ�Ϊ0.047��0.006��0.047������ϩ�ķ�ѹΪp��C2H4����________kPa��ƽ�ⳣ��Kp��________��KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��������������1λС������
�ۺ��º����ܱ������н��еķ�Ӧ������˵���Ѵﵽƽ��״̬����________������ĸ����
a��ѹǿ������ʱ��仯 b����������ܶȲ�����ʱ��仯
c��v��H2������v��CO���� d����λʱ���ڶ���C��O����Ŀ�����H��O�����
������ֱ���ѽ��Լ���CO2����ѽ���ܷ����ķ�Ӧ��ƽ��ת���ʣ��������¶ȣ�T���Ĺ�ϵ�ֱ�����ͼ��ʾ����֪��a��C2H6=C2H4��H2��b��C2H6��CO2=C2H4��CO��H2O��c��C2H6��2CO2=4CO��H2��d��2C2H6��CO2=C2H4��2CO��2H2��CH4��e��16C2H6��9CO2=14C2H4��12CO��12H2��6H2O��CH4��

����˵����ȷ����________������ĸ����
a��600�����£���Ӧa���������
b��CO2��C2H6����ѽ���������������ƽ��ת����
c������CO2��C2H6��ϸ����ѽ⣬�ɽϺ÷�ֹ���������̿
d���ú��ʵĴ�����CO2��C2H6����ѽ⣬����߷�Ӧƽ�ⳣ��
��3����̫���ܵ��Ϊ��Դ�����õ�ⷨҲ��ʵ��CO2�Ʊ���ϩ����װ����ͼ��ʾ���缫aΪ��Դ��________�������������������������ϩ�ĵ缫��ӦʽΪ________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K4[Fe(CN)6]�������������ᡢҩ��ȡ�
(1)Fe2+�ĺ�������Ų�ʽΪ_____��
(2)CN����Cԭ�ӹ�����ӻ�����Ϊ_____����CN����Ϊ�ȵ������һ�ַ��ӵĽṹʽΪ_____��
(3)[Cu(H2O)4]2+�ṹʾ��ͼ��ͼ��ʾ��[Fe(CN)6]4���ṹʾ��ͼ��ͼ��ʾ������ͼ����Ӧλ�ò�������_________��

(4)��֪3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2��+2N2����(CN)2��������������������Ŀ��n(��)��n(��)��_____��
12KCN+Fe3C+3C+(CN)2��+2N2����(CN)2��������������������Ŀ��n(��)��n(��)��_____��
(5)����ý�Ǻϳɰ���Ӧ�Ĵ������������ڵ�ԭ�ӡ���ԭ�����������ϵĵ��㸽�žֲ�ʾ����ͼ��ʾ�����������ϵ�ԭ������ԭ�ӵ���Ŀ��Ϊ_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Է��㻯����AΪԭ���Ʊ����������ͪ�м��壨G����һ�ֺϳ�·�����£�

�ش��������⣺
��1��A�Ļ�ѧ������________��A��B���Լ�����Ӧ����������________��
��2��E��F�ķ�Ӧ������________��
��3��D�Ľṹ��ʽΪ________��
��4��G�еĺ�������������Ϊ________��
��5�����㻯����X��F��ͬ���칹�壬X�ܷ���������Ӧ��ˮ�ⷴӦ���˴Ź���������4����ҷ����֮��Ϊ6�U6�U1�U1��д��һ�ַ�������������X�Ľṹ��ʽ��________��
��6��PES���۶������Ҷ���������һ�ֿ����オ���;����������1��2����������Ϊ��ʼԭ���Ʊ�PES�ĺϳ�·�ߣ�________�����Լ����ã���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A+B=3C+4D��Ӧ�У���ʾ�÷�Ӧ��������������
A. v(A)=0.5mol��L-1��s-1 B. v(B)=3mol��L-1��min-1
C. v(C)=0.9mol��L-1��s-1 D. v(D)=1.0mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ�����Ļ�ѧ����ʽ��4HCl(Ũ)+MnO2 ![]() Cl2��+MnCl2 +2H2O ��
Cl2��+MnCl2 +2H2O ��
(1)��Ӧ��HCl����Ԫ�صĻ��ϼ�____��HCl�ڷ�Ӧ�б��ֵ����ʰ���_______��______��
(2)�ڸ�������ԭ��Ӧ�У�MnO2 ��_________������Ԫ�ر�________��
(3)д���÷�Ӧ�����ӷ���ʽ�����õ����ŷ��������ת�Ƶķ������Ŀ��_______________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com