
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

(1)写出甲中正极的电极反应式_____________________________。
(2)写出乙电池中总反应的离子方程式: ___________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________(填写元素符号,下同)的金属活动性更强,而乙会判断出________的金属活动性更强。
(4)由此实验,可得到如下哪些正确结论
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属活动性不一定比铝的金属活动性强
C.该实验说明金属活动性顺序表已过时,已没有使用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正、负极”这种做法_________(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正、负极的可行实验___________ (如可靠,可不填写)。
(6)将5.1g镁铝合金溶于60mL 5.0 mol·L-1H2SO4溶液中,完全溶解后再加入65mL 10.0mol·L-1的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。
①当加入 mL NaOH溶液时,可使溶解在硫酸的Mg2+和Al3+恰好完全沉淀。
②合金溶于硫酸时所产生的氢气在标准状况下的体积为 L。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年山东省高一6月月考化学试卷(解析版) 题型:选择题
既可用来鉴别甲烷与乙烯,又可除去甲烷中混有乙烯的最佳方法是
A.通入酸性高锰酸钾溶液中 B.通入足量溴水中
C.一定条件下通入H2 D.点燃
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一5月月考化学试卷(解析版) 题型:选择题
下列各组中两个化学反应,属于同一反应类型的一组是
A. 由苯制溴苯;由乙醇与乙酸反应制乙酸乙酯
B. 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷
C. 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色
D. 由苯制硝基苯;由苯制环己烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下学期期中化学试卷(解析版) 题型:选择题
下列物质化学性质的说法正确的是
A.SO2、CO2性质相似,都能在水溶液中被氯气氧化
B.Na2O2、Na2O组成元素相同,与CO2反应产物也相同
C.Mg和K在一定条件下与水反应都生成H2和对应的碱
D.Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下学期期中化学试卷(解析版) 题型:选择题
下列各组大小关系比较中错误的
A.热稳定性:Na2CO3>NaHCO3 B.酸性:H2CO3>HClO
C.氧化性:浓硝酸>稀硝酸 D.结合OH- 的能力:NH4+>Al3+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点)
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:选择题
柠檬烯是一种食用香料,其结构简式如图。有关柠檬烯的分析正确的是( )
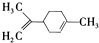
A.它的一氯代物有6种
B.它和丁基苯(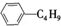 )互为同分异构体
)互为同分异构体
C.它的分子中所有的碳原子一定在同一平面上
D.一定条件下,它分别可以发生加成、取代、氧化、还原反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:填空题
观察下面几种烷烃的球棍模型
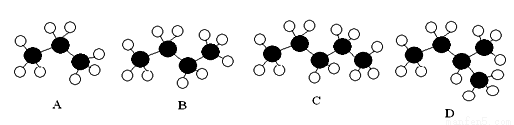

(1)与C互为同系物的是___________,与C互为同分异构体的是_______________。
(2)在烷烃的同系物中,随碳原子数增加,其熔、沸点依次_______(其中碳原子数满足______条件的烷烃常温下呈气态),液态时密度依次___________。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:实验题
【化工与技术--选作】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡 工业。某研究小组设计SnSO4制备路线如下:
工业。某研究小组设计SnSO4制备路线如下:
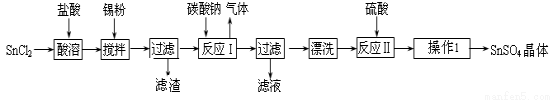
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119。
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
 (2)操作Ⅰ是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两 个:①调节溶液pH ② 。
个:①调节溶液pH ② 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl 2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是 。
2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com