
【题目】铬和铜都是人体所必需的微量元素。回答下列问题:
(1)铬原子的最高能层符号是_______,其价层电子的轨道表达式(电子排布图)为_______。
(2) 比较第二电离能Cu______Zn(填“>”、“=”、“<"),理由是_________。
(3)铬的一种氧化物常温下呈蓝色,化学式为CrO5,已知该氧化物中铬为+6价,请写出CrO5的结构式___________。
(4)氧化亚铜溶于浓氨水中形成无色配离子[Cu(NH3)2]+,则该配离子中铜的化合价为________,杂化类型为_________。[Cu(NH3)2]2SO4中阴离子的立体构型是_________。
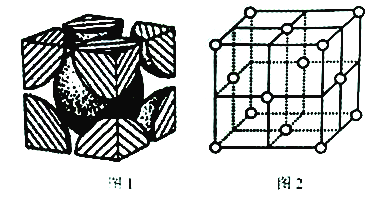
(5)已知图1为铬的晶胞结构图,则铬晶胞属于______堆积,晶跑中实际拥有的铬原子数为_______;图2是铜的晶胞结构图,若其立方晶胞参数为a nm,该晶胞中原子的体积占晶胞体积的百分率为_______。
【答案】 N 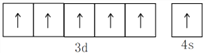 > 测试第二电离能时铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,之后价电子层形成稳定状态的3d10
> 测试第二电离能时铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,之后价电子层形成稳定状态的3d10 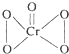 +1 sp 正四面体 体心立方 略 74%(或
+1 sp 正四面体 体心立方 略 74%(或 ![]() 或
或![]()
![]() 或
或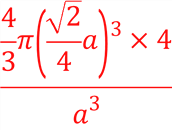 )
)
【解析】试题分析:(1)铬原子的有4个电子层,第四层能量最高;其价层电子的电子排布式是3d54s1;(2)第二电离能,铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,之后价电子层形成稳定状态的3d10;(3)该氧化物中铬为+6价,说明Cr与O原子写成6个共价键;(4)根据[Cu(NH3)2]+中NH3的化合价为0计算铜的化合价;Cu+的核外电子排布是3d10,形成配合物时,会先激发一个电子到4p轨道中;SO42-中S原子的价电子对数是![]() ,无孤对电子;(5)根据铬的晶胞结构图,晶胞顶点、体心各有1个铬原子;根据均摊原则计算晶跑中实际拥有的铬原子数;根据晶胞边长计算铜原子的体积,根据均摊原则计算晶跑中实际拥有的铜原子数,铜原子实际体积
,无孤对电子;(5)根据铬的晶胞结构图,晶胞顶点、体心各有1个铬原子;根据均摊原则计算晶跑中实际拥有的铬原子数;根据晶胞边长计算铜原子的体积,根据均摊原则计算晶跑中实际拥有的铜原子数,铜原子实际体积![]() 晶胞的体积即晶跑中原子的体积占晶胞体积的百分率;
晶胞的体积即晶跑中原子的体积占晶胞体积的百分率;
解析:(1)铬原子的有4个电子层,第四层能量最高,最高能层符号是N;其价层电子的电子排布式是3d54s1,轨道表达式(电子排布图)为![]() ;(2)第二电离能,铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,所以第二电离能Cu>Zn;(3)铬的一种氧化物常温下呈蓝色,化学式为CrO5,该氧化物中铬为+6价,说明Cr与O原子写成6个共价键, CrO5的结构式是
;(2)第二电离能,铜原子失去的是处于全充满稳定状态的3d10电子;而锌原子失去的是4s1电子,所以第二电离能Cu>Zn;(3)铬的一种氧化物常温下呈蓝色,化学式为CrO5,该氧化物中铬为+6价,说明Cr与O原子写成6个共价键, CrO5的结构式是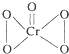 ;Cu+的核外电子排布是3d10,形成配合物时,会先激发一个电子到4p轨道中,杂化类型为sp;SO42-中S原子的价电子对数是
;Cu+的核外电子排布是3d10,形成配合物时,会先激发一个电子到4p轨道中,杂化类型为sp;SO42-中S原子的价电子对数是![]() ,无孤对电子,所以立体构型是正四面体;(5)已知图1为铬的晶胞结构图,晶胞顶点、体心各有1个铬原子,属于体心立方堆积;根据均摊原则计算晶跑中实际拥有的铬原子数
,无孤对电子,所以立体构型是正四面体;(5)已知图1为铬的晶胞结构图,晶胞顶点、体心各有1个铬原子,属于体心立方堆积;根据均摊原则计算晶跑中实际拥有的铬原子数![]() ;晶胞参数为a nm,晶胞的体积为
;晶胞参数为a nm,晶胞的体积为![]() ,则铜原子的半径是
,则铜原子的半径是![]() ,根据均摊原则晶跑中实际拥有的铜原子数
,根据均摊原则晶跑中实际拥有的铜原子数![]() ,铜原子的体积是
,铜原子的体积是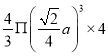 ,晶胞中原子的体积占晶胞体积的百分率为
,晶胞中原子的体积占晶胞体积的百分率为
![]()
![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知:Ka 为平衡常数,pKa=﹣lgKa,25℃时,H2A的 pKa1 =1.85,pKa2=7.19。用 0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如下图所示(曲线上的数字为 pH)。下列说法不正确的是

A.a 点所得溶液中;2c(H2A)+c(A2-)=0.002mol
B.b 点所得溶液中:c(H2 A)+c(H+)=c(A2-)+C(OH-)
C.C 点所得溶液中:c(Na+)<3c(HA-)
D.d 点所得溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室模拟工业硫化碱法制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取硫代硫酸钠的反应装置及所需试剂如图:
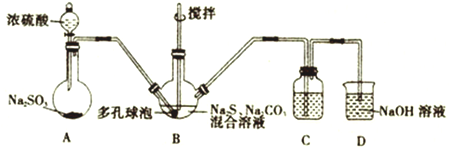
①装置A中发生反应的化学方程式为__________________________。打开分液漏斗的活塞时,发现液体不能顺利滴下,可能的原因是__________________________________。
②装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为______________________________。
③装置C是为了检验装置B中SO2的吸收效率,则C中的试剂为________________,当B中SO2的吸收效率低时,C中的现象为________________________,除搅拌和使用多孔球泡外,再写出一种提高B中SO2的吸收效率的方法:______________________________。
(2)预测并探究硫代硫酸钠的性质(反应均在溶液中进行):
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | _________ | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3 | ______ |
①探究1中的实验操作为________________________。
②探究2中的实验现象为_____________________,反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中正确的是( )
A. 苯与H2在一定条件下的加成产物环己烷![]() 中,所有碳原子在同一平面上
中,所有碳原子在同一平面上
B. ![]() 可以用于表示苯的分子结构,但是其中并不含有碳碳双键,因此苯的性质跟烯烃不相同
可以用于表示苯的分子结构,但是其中并不含有碳碳双键,因此苯的性质跟烯烃不相同
C. 苯的分子式是C6H6,苯分子中的碳原子远没有饱和,因此能与溴水发生加成反应而使之褪色
D. 苯环上的碳碳键是一种介于单键和双键之间的独特的键,因此苯可以发生取代反应不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上新建的金矿中约有80%都采用氧化法提金。某工厂利用锌冶炼渣回收金、银等贵金属的流程如下图所示:

已知:HCN有剧毒,其Ka(HCN)=5×10-10,
Au++2CN-=[Au(CN)2]-平衡常数KB=1×1038
(1)磨矿细度对浸出率的影响如图所示,依据浸出率应选择磨矿细度_____为宜。

(2)生产中用生石灰调节矿泥pH>11.5,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是________________(用离子方程式表示)。
(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,将Au转换为Na[Au(CN)2]。
①其化学方程式为________________。
② “氰化”环节中,金的溶解速率在80℃时达到最大值,但生产中控制反应液的温度在10-20℃,原因是:___________________________(答一点即可)。
③已知2H++[Au(CN)2]-![]() Au++2HCN,该反应的K=____________。
Au++2HCN,该反应的K=____________。
(4)用锌还原NaAu(CN)2生成金,消耗的锌与生成的金的物质的量之比为____________。
(5)氰化物有剧毒,经合理处理就可以基本消除对环境的负面影响。H2O2可消除水中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑。
①生成物A的化学式为______________。
②某废水用H2O2处理40min后,测得剩余总氰为0.16mg/L,除氰率达80%,计算0-40min时间段反应速率v(CN-)=____mg/(L·min)(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是

A. 图I是加入适当催化剂的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中正确的是( )
A. 苯与H2在一定条件下的加成产物环己烷![]() 中,所有碳原子在同一平面上
中,所有碳原子在同一平面上
B. ![]() 可以用于表示苯的分子结构,但是其中并不含有碳碳双键,因此苯的性质跟烯烃不相同
可以用于表示苯的分子结构,但是其中并不含有碳碳双键,因此苯的性质跟烯烃不相同
C. 苯的分子式是C6H6,苯分子中的碳原子远没有饱和,因此能与溴水发生加成反应而使之褪色
D. 苯环上的碳碳键是一种介于单键和双键之间的独特的键,因此苯可以发生取代反应不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述正确的是
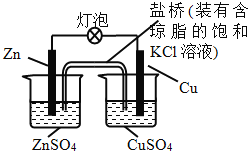
A. 盐桥中的K+移向ZnSO4溶液
B. 电流从锌片经导线流向铜片
C. 铜片质量逐渐减少
D. 铜离子在铜片表面被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com