


科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,543.4g |
| C、任意规格,572g |
| D、1000mL,286g |
查看答案和解析>>
科目:高中化学 来源: 题型:
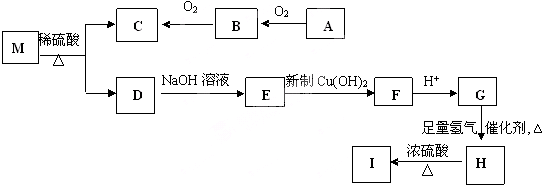
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | ||||
| S | 112.8 | 444.6 | 略 | ||||
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;300℃以上完全分解; S2Cl2+Cl2
|

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O |
| C、向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| D、氯气通入水中:Cl2+H2O?H++HClO+Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com