
【题目】在含c(NH4Cl)=3c(AlCl3)的溶液中滴加稀NaOH溶液。下列离子方程式不符合实际情况的是( )
A. Al3++3NH![]() +6OH-===Al(OH)3↓+3NH3·H2O
+6OH-===Al(OH)3↓+3NH3·H2O
B. Al3++5NH![]() +9OH-===5NH3·H2O+AlO
+9OH-===5NH3·H2O+AlO![]() +7H2O
+7H2O
C. 2Al3++NH![]() +7OH-===2Al(OH)3↓+NH3·H2O
+7OH-===2Al(OH)3↓+NH3·H2O
D. Al3++3NH![]() +7OH-===AlO
+7OH-===AlO![]() +3NH3·H2O+2H2O
+3NH3·H2O+2H2O
【答案】B
【解析】试题分析:在含c(NH4Cl)=3c(AlCl3)的溶液中,氨根离子与铝离子物质的量之比为3:1,A.向溶液中加入氢氧化钠,氢氧化钠先与铝离子反应生成氢氧化铝,然后再与氨根离子反应生成一水合氨,则反应的离子方程式:Al3++3NH4++6OH-=Al(OH)3↓+3NH3H2O,A正确;B.溶液中有1mol铝离子,则溶液中含有3mol氨根离子,离子个数比不符合,B错误;C.加入7mol氢氧化钠,先与2mol铝离子发生反应:
2Al3++6OH-=2Al(OH)3↓,剩余1mol氢氧化钠只能反应1mol氨根离子反应,离子方程式:NH4++OH-=NH3H2O,合在一起为:2Al3++NH4++7OH-=2Al(OH)3+NH3H2O,C正确;D.1mol铝离子、3mol氨根离子完全反应生成偏铝酸根离子和一水合氨需要消耗氢氧化钠7mol,所以当向溶液中加入的氢氧化钠的物质的量是铝离子物质的量的7倍以上时发生的反应离子方程式为:Al3++2NH4++6OH-=AlO2-+2NH3H2O+2H2O,D正确;答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.
(1)该氮氢化合物的电子式为 .
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式 .
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,在① ~⑩元素中,试用元素符号或化学式等化学用语回答下列问题:
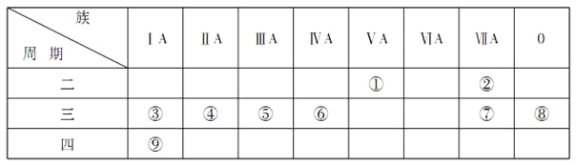
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是,碱性最强的是
(3)用电子式表示②与④形成化合物的过程
(4)单质⑤与③的最高价氧化物对应的水化物反应的离子方程式是
(5)①和⑥形成的化合物是一种新型的高温结构陶瓷,该化合物中含有的化学键类型是
(6)②③和⑦元素的原子半径由大到小的顺序是__________,它们形成的简单离子中,离子半径由大到小的顺序是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六组物质:属于同系物的是 ,属于同分异构体是 ,属于同种物质的是 .(填序号)
A.![]() 与
与![]()
B.![]() 与
与![]()
C.![]() 与
与![]()
D.![]() 与
与![]()
E.ClC(CH3)3与(CH3)2CHCH2Cl
F.![]() 与CH3﹣CH2Cl.
与CH3﹣CH2Cl.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究影响化学反应速率的影响因素,将等质量的铁与过量盐酸反应,其他实验条件见下表。其中铁被反应完消耗时间最少的组别是
组别 | c(HCl)/ mol·L-1 | 温度/℃ | 铁的状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 粉末状 |
C | 2.5 | 50 | 块状 |
D | 2.5 | 50 | 粉末状 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2==="2AgCl" 。下列说法正确的是
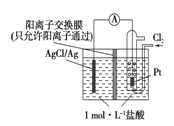
A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某有机物分子的比例模型,有关该物质的推断不正确的是( )

A.分子中可能含有羟基
B.分子中可能含有羧基
C.分子中可能含有氨基
D.该物质的化学式可能为C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神十搭载的长征F改进型火箭推进剂之一为无色气体N2O4.N2O4与NO2转换的热化学方程式为:N2O4(g) ![]() 2NO2(g) △H=+24.4KJ/mol
2NO2(g) △H=+24.4KJ/mol
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色 (填“变深”、“变浅”或“不变”),判断理由____________________。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:p(NO2)=p总×x(NO2)。写出上述反应平衡常数Kp表达式 (用p总、各气体物质的量分数x表示)。影响Kp的因素为___________;
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·P2(NO2),其中k正、k逆为速率常数,则Kp为________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×l04s-1,当N2O4分解10%时,v正=__________kPa·s-1;
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为a。保持温度不变,向密闭容器中充人等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com