
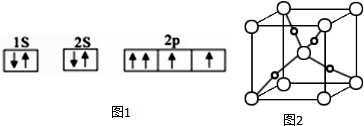
分析 (1)由图1电子轨道排布图可知,2p能级的其中1个轨道2个电子自旋方向相同,违背泡利原理;
(2)Cu2+ 含有空轨道,为中心离子,而NH3中的N原子含有孤对电子,NH3为配体;
(3)根据价层电子对互斥理论确定该分子的空间构型;等电子体是指具有相同电子总数和原子总数的分子或离子;根据价层电子对互斥理论确定N原子轨道杂化类型;等电子体结构相似,O22+和N2分子为等电子体,其结构和N2结构相似,根据氮气分子结构计算1mol O22+中含有的π键数目;
(4)根据均摊法可知,晶胞中大球数目为2,小球数目为4,二者数目之比为1:2,由于为Cu2O晶胞的结构,故大球为O原子、小球为Cu原子,结合氧原子配位数确定.
解答 解:(1)由图1电子轨道排布图可知,2p能级的其中1个轨道2个电子自旋方向相同,违背泡利不相容原理,
故答案为:错误;违背泡利不相容原理;
(2)Cu2+ 含有空轨道,为中心离子,接受电子,氨气的电子式为 ,而NH3中的N原子含有孤对电子,给出孤电子对,NH3为配体;
,而NH3中的N原子含有孤对电子,给出孤电子对,NH3为配体;
故答案为:氮原子(或N);
(3)OF2分子中O原子价层电子对个数=2+$\frac{6-1×2}{2}$=4,且含有2个孤电子对,所以其空间构型为V形,NO2+中含有3个原子、22个电子数,则与NO2+等电子体的分子有N2O、CO2等;NO2+离子中氮原子价层电子对个数为:2+$\frac{1}{2}$(5-1-2×2)=2,所以NO2+中氮原子为sp杂化;O22+和N2分子为等电子体,其结构和N2结构相似,一个氮气分子中含有2个π键,所以一个O22+中含有两个π键,则1mol O22+中含有的π键数目为2NA,
故答案为:V形;N2O、CO2;sp;2NA;
(4)根据均摊法可知,晶胞中大球数目为8×$\frac{1}{8}$+1=2,小球数目为4,二者数目之比为1:2,由于为Cu2O晶胞的结构,故大球为O原子、小球为Cu原子,氧原子配位数为4,则该晶胞中,Cu+的配位数是2,
故答案为:2.
点评 本题考查物质结构和性质,为高频考点,涉及核外电子排布、配位键、杂化轨道理论、晶体结构计算等知识,题目难度中等,注意掌握判断原子轨道杂化方式的方法,试题培养了学生分析、理解能力及灵活应用能力,难点是晶胞计算,易错点为(3).


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结 论 |
| A | 向盛有2mL 0.1mol/L AgNO3溶液的试管中,先滴几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,静置分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| C | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性: HClO>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 题中操作可证明Na2SO3溶液是否被氧化 | |
| D. | 此实验不能确定Na2SO3是否部分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将产物通过碱石灰,则不能被完全吸收 | |
| B. | 若将产物通过浓硫酸,充分吸收后,浓硫酸增重18g | |
| C. | 产物的平均摩尔质量为24g.mol-1 | |
| D. | 反应中消耗O256g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L•min | B. | 1 mol/L•min | C. | 0.5 mol/L•min | D. | 0.6 mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①常用于分离互不相溶的液体 | B. | 装置②可用于吸收NH3 | ||
| C. | 装置③可用于收集NO、CO2等气体 | D. | 装置④可用于制备乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com