
(11分)某研究性学习小组验证浓硝酸与铜银合金反应时除生成NO2气体外还会生成少量的NO气体。查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为此,他们设计了如下图所示的验证实验装置(图中略去了次要装置)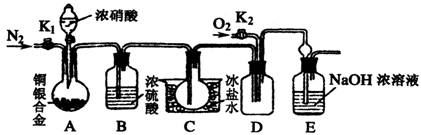
请回答下列问题:
(1)写出A瓶中铜与硝酸可能发生的反应方程式:
、 。
(2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
(4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 实验操作步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组验证浓硝酸与铜银合金反应时除生成NO2气体外还会生成少量的NO气体。查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为此,他们设计了如下图所示的验证实验装置(图中略去了次要装置)
![]()

![]() 请回答下列问题:
请回答下列问题:
![]() (1)写出A瓶中铜与硝酸可能发生的反应方程式:
(1)写出A瓶中铜与硝酸可能发生的反应方程式:
![]() 、 。
、 。
![]() (2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
(2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
![]() (3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
![]() (4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
(4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:

请回答下列问题:
(1)写出A瓶中铜与硝酸可能发生反应的化学方程式;______________________。
(2)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这
样做的目的是______________________________________________;装置中B瓶的作用是____________________________________________________________________。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是__________________;实验发现,通入氧气温度的高低对实验现象有较大影响,为便于观察应通入___________(填“冷”或“热”)的氧气。
(4)已知合金的质量为a,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以达到目的。请简述实验过程:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com