
����Ŀ������ȫ�������������أ�Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ����������о�����Ч���ƿ����е������̼���������Ⱦ����һ����Ҫ����Ĺ�����
I������������о�
��1��һ�������£���2molNO��2molO2���ں����ܱ������з�����Ӧ�� 2NO(g)+O2(g) ![]() 2NO2(g)������״̬��˵���÷�Ӧ�ﵽ��ѧƽ�����_______
2NO2(g)������״̬��˵���÷�Ӧ�ﵽ��ѧƽ�����_______
A�����������ܶȱ��ֲ��� B��NO��ת���ʱ��ֲ���
C��NO��O2�����ʵ���֮�ȱ��ֲ��� D��O2���������ʺ�NO2�������������
��2����֪��Ӧ��2NO(g) ![]() N2(g)+O2(g) ��H<0���ڲ�ͬ����ʱN2�����������ʱ��(t)�ı仯��ͼ��ʾ������ͼ������ж�����R1��R2��Ӧ�������з�Ӧ�����е�______ (����ĸ���)��
N2(g)+O2(g) ��H<0���ڲ�ͬ����ʱN2�����������ʱ��(t)�ı仯��ͼ��ʾ������ͼ������ж�����R1��R2��Ӧ�������з�Ӧ�����е�______ (����ĸ���)��
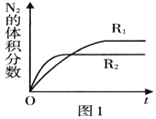
A��ѹǿ B���¶� C������
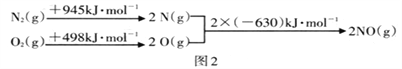
������ͼ�е������仯���ݣ����㷴Ӧ��2NO(g) ![]() N2(g)+O2(g) �Ħ�H=__________
N2(g)+O2(g) �Ħ�H=__________
II��̼��������о�
��3��CO��H2��һ�������¿��Ժϳɼ״���CO(g)+2H2(g)![]() CH3OH(g) ��H<0,�������Ϊ1L�ĺ����ܱ�����(��ͼ��)��ͨ��1molCO��2molH2���ⶨ��ͬʱ�䡢��ͬ�¶�(T)��������CO�����ʵ��������±���
CH3OH(g) ��H<0,�������Ϊ1L�ĺ����ܱ�����(��ͼ��)��ͨ��1molCO��2molH2���ⶨ��ͬʱ�䡢��ͬ�¶�(T)��������CO�����ʵ��������±���

��ش�
T1_____ T2���>����<����=��������֪T2��ʱ����20minʱ������ѹǿ���ٸı䣬��ʱH2��ת����Ϊ_________ ��
��4����֪��Ksp[Al(OH)3]��1��10��33��Ksp[Fe(OH)3]��3��10��39��pH��7.1ʱMn(OH)2��ʼ�����������£���ȥMnSO4��Һ�е�Fe3����Al3��(ʹ��Ũ�Ⱦ�С��1��10��6 mol��L��1)���������ҺpH��ΧΪ________��
���𰸡� BC B ��183kJ.mol-1 �� 50%��0.5 5.0��pH��7.1
��������(1)�жϻ�ѧ��Ӧ�Ƿ�ﵽƽ�����ͨ�����淴Ӧ������Ȼ����ֵ�ijһ���������ֲ��������A���ں����ܱ�����������ѧƽ��2NO(g)+O2(g) ![]() 2NO2(g) �Ļ��������ܶ�ʼ�ձ��ֲ�������A����ȷ��NO��ת���ʱ��ֲ����Լ�NO��O2�����ʵ���֮�ȱ��ֲ��䶼��ȷ����Ӧ�Ѿ��ﵽƽ��״̬������B��C����ȷ��D��O2����������������Ӧ���ʣ�NO2�������������淴Ӧ���ʣ����������������ڷ�Ӧ�еĻ�ѧ��������ͬ�����Զ�����Ȳ���˵���ﵽƽ��״̬��D������ȷ��ΪBC��
2NO2(g) �Ļ��������ܶ�ʼ�ձ��ֲ�������A����ȷ��NO��ת���ʱ��ֲ����Լ�NO��O2�����ʵ���֮�ȱ��ֲ��䶼��ȷ����Ӧ�Ѿ��ﵽƽ��״̬������B��C����ȷ��D��O2����������������Ӧ���ʣ�NO2�������������淴Ӧ���ʣ����������������ڷ�Ӧ�еĻ�ѧ��������ͬ�����Զ�����Ȳ���˵���ﵽƽ��״̬��D������ȷ��ΪBC��
(2) ��֪2NO(g) ![]() N2(g)+O2(g) ��H<0����ͼ���֪��R2�����R1�����ʼӿ��ˣ�ƽ�����淴Ӧ�ƶ��ˣ�����һ����Ӧǰ�������������ķ��ȷ�Ӧ�����Լ�ѹƽ�ⲻ�ƶ���ʹ�ô���ƽ��Ҳ���ƶ�������ֻ���¶ȷ���Ҫ��ѡB��
N2(g)+O2(g) ��H<0����ͼ���֪��R2�����R1�����ʼӿ��ˣ�ƽ�����淴Ӧ�ƶ��ˣ�����һ����Ӧǰ�������������ķ��ȷ�Ӧ�����Լ�ѹƽ�ⲻ�ƶ���ʹ�ô���ƽ��Ҳ���ƶ�������ֻ���¶ȷ���Ҫ��ѡB��
��H=��Ӧ����ܼ�������������ܼ���=2��630kJ/mol��(945 kJ/mol+498 kJ/mol)= -183 kJ/mol��
(3)�ɱ������ݿ�֪������ͬʱ�����T2��Ӧ��CO���٣�˵����Ӧ���ʿ�����T2��Ӧ���¶ȸ���T1����T1< T2��

����H2��ת����Ϊ=![]() ������0.5����
������0.5����
(4)�����£�Ҫ��ȥMnSO4��Һ�е�Fe3����Al3��������pH��7.1ʱMn(OH)2��ʼ���������Կ���pHһ��С��7.1����Ksp[Al(OH)3]��1��10��33��Ksp[Fe(OH)3]��3��10��39��֪����Al3��������ȫʱ��Fe3��Ҳ������ȫ����������Ksp[Al(OH)3]��c(Al3��) ��c(OH��)3=1��10��6 ��c(OH��)3=1��10��33�����c(OH��)= 1��10��9 mol��L��1����pH=5.0������ȷ��Ϊ5.0��pH��7.1


 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д� �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�ij����װ��CO2ʱ������Ϊ88.8 g������������װ��O2ʱ��������Ϊ 86.4 g,����������ݻ�Ϊ
A.1.12 LB.2.24 LC.3.36LD.4.48 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��ʱ��Ksp[Zn(OH)2]=1.0��10-18��Ka(HCOOH)=1.0��10-4�����¶��£�����˵���������
A. Zn(OH)2����ˮ�γɵı�����Һ��c(Zn2+)>1.0��10-6 mol��L-l
B. HCOO-��ˮ�ⳣ��Ϊ1.0��10-10
C. ��Zn(OH)2����Һ�м���HCOOH,��Һ��c(Zn2+)����
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O��ƽ�ⳣ��K=100
=Zn2++2HCOO-+2H2O��ƽ�ⳣ��K=100
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С��ⶨij�����ʵ���ɣ��ٶ�ֻ��C��H��O��NԪ�أ����������ʵ�飨�г�װ����ȥ����
I.��Ʒ��̼���⺬���IJⶨ

��1������a������Ϊ___________________________��
��2������g������Ϊ______________________________________��
��3��ѡ������װ�ã������������ҵķ�����������˳��Ϊ____________________�����д��ĸ���������ظ�ʹ�ã�����ˮ���ռ�����װ�á�
��4����ȡ4.65g��������Ʒ�����������Ӻõ�װ�ý���ʵ�顣
�ٳ�ַ�Ӧ��Ϩ��D���ƾ���֮ǰ�������ͨ��O2��Ӳ�ʲ�������ȴ��ԭ��Ϊ__________________��
�ڳ�ַ�Ӧ������ڽ����������ļ�ʯ�Һ�P2O5�ֱ�����7.7g��2.25g��
��.��Ʒ�е�Ԫ�غ����IJⶨ
��֪���ڴ��������£�Ũ�����ܽ���Ʒ�еĵ�Ԫ��ת��Ϊ��Ρ�
i.���³�ȡ4.65g��������Ʒ�������еĵ�Ԫ��ȫ��ת��Ϊ��Σ�
ii.�������������NaOH��Һ��Ӧ������100mLl mol��L-l���Ὣ���ɵİ���ȫ�����գ�
iii.������Һϡ����500mL��
iv.ȡ25.00mLϡ�ͺ����Һ����0.1000 mol��L-l��NaOH��Һƽ�еζ���ƽ�����ı�Һ25.00mL��
��5����������Ʒ��C��H��N��O��ԭ����Ŀ֮��Ϊ_____________________��������iii�ж���ʱ��������ƿ�̶��ߣ������Ԫ�غ���___________(�ƫ�ߡ���ƫ�͡�����Ӱ�족)��
��6����ͬѧ��Ϊ��ͨ����3�����ռ���������������ɵõ���Ԫ�صĺ���������Ϊ��۵�___________(���ȷ��������ȷ��)������Ϊ________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijHNO3��Fe(NO3)3�Ļ����Һ���������ۣ�������ɫ���壬�����������������ɫ����Һ��Fe2��Ũ�Ⱥͼ���Fe�۵����ʵ���֮��Ĺ�ϵ����ͼ��ʾ����ԭϡ��Һ��HNO3��Fe(NO3)3�����ʵ���Ũ��֮��Ϊ(����)

A. 4��1 B. 3��1 C. 2��1 D. 1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȡ��������Ҫ���л��ϳɲ��Ϻ�ҩ���м��塣ʵ�����ɷ��㻯����A����B�Ʊ�1-�һ���(M)��һ�ֺϳ�·�����£�

��֪����.B�ĺ˴Ź�����������2�����շ�
��. 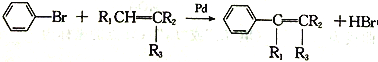 ��R1��R2��R3��ʾHԭ�ӻ�������
��R1��R2��R3��ʾHԭ�ӻ�������
��. 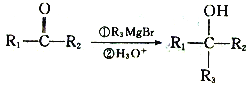 ��R1��R2��R3��ʾHԭ�ӻ�������
��R1��R2��R3��ʾHԭ�ӻ�������
��ش��������⣺
��1��A�Ļ�ѧ����Ϊ________________��,B�Ľṹ��ʽΪ________________________��
��2��B��C�ķ�Ӧ����Ϊ_______________________��
��3��D�ķ���ʽΪ_____________________��F�й����ŵ�����Ϊ_______________________��
��4��G��H�Ļ�ѧ����ʽΪ_____________________________��
��5������������M��ͬ���칹�廹��_______�֣����к˴Ź�������Ϊ�����Ľṹ��ʽ_________����дһ�֣���
��6�����������ϳ�·�ߺ���Ϣ���Ա�ͪ���屽Ϊԭ�ϣ��������Լ���ѡ��������Ʊ�![]() �ĺϳ�·��_______________________________________��
�ĺϳ�·��_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���H2��g����I2��g����0.9 mol����̬��������2 L���ܱ������У���ַ�Ӧ��5 min��ﵽƽ�⣬���c(HI)��0.3 mol/L����д��������̣�
��1������ӷ�Ӧ��ʼ���ﵽƽ�⣬��H2��g����ʾ�ķ�Ӧ����________________��
��2�������¶Ȳ��䣬�������������г���H2��g����I2��g����2 mol,��ﵽƽ��ʱI2��g�������ʵ���Ũ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Pb�缫��⺬��Cu2+��X3+��Ϊ0.1mol����Һ��������������������m����Һ��ͨ�����ӵ����ʵ���n��ϵ��ͼ�������ӵ������������ɴ�С������ȷ���ǣ� ��

A. Cu2+��X3+��H+ B. H+��X3+��Cu2+
C. X3+��H+��Cu2+ D. Cu2+��H+��X3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʯī���缫������Է�ˮ���ɽ���ˮ�е�PO43-��FePO4(������ˮ)����ʽ��ȥ����װ����ͼ��ʾ��
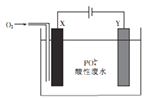
����˵����ȷ����
A. ��X��Y�缫�������ӷ��ˣ����Կɽ���ˮ�е�PO43-��ȥ
B. X��Ϊʯī���õ缫�Ϸ���������Ӧ
C. ��������Y����Χ��Һ��pH��С
D. ���ʱ��ˮ�лᷢ����Ӧ:4Fe2++02-4H++4P043-=4FePO4��+2H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com