
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 050 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
分析 (1)根据v=$\frac{△c}{△t}$解题;
(2)实验1和实验2达到平衡时A的浓度不再改变且相等,说明实验2与实验1其他条件完全相同,实验2使用了催化剂,加快了反应速率,缩短了达平衡的时间;
(3)以10至20min为例求出实验1和实验3的反应速率进行比较;
(4)根据化学平衡移动原理分析,加热平衡向吸热反应方向移动.
解答 解:(1)在实验1中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,
故答案为:0.013;
(2)实验1和实验2达到平衡时A的浓度不再改变且相等,说明实验2与实验1其他条件完全相同,实验1与实验2中A的初始浓度应相等,起始浓度c2=1.0mol/L,实验2较其他实验达到平衡时间最短,是使用了合适的催化剂,
故答案为:1.0;催化剂;
(3)在实验1中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,
在实验3中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.92mol/L-0.75mol/L}{10min}$=0.015mol•(L•min)-1,故v3>v1,实验1的其实浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,
故答案为:>;>;
(4)比较实验4和实验1可知平衡时实验4反应物A的浓度小,由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动;
故答案为:吸热;由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
点评 本题考查反应速率的表示方法,化学平衡移动的判断,掌握反应速率的计算方法是解题的关键,题目难度中等.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 23gNa一定条件下与足量的O2反应转移的电子数一定为NA | |
| B. | 标准状态下,2.24LCCl4中的分子数目为0.1NA | |
| C. | 1L1 mol/L饱和FeCl3溶液滴入沸水中完全水解生成NA个氢氧化铁胶体粒子 | |
| D. | 0.1 mol•L-1 氢氧化钠溶液中所含钠离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
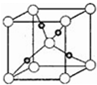 ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
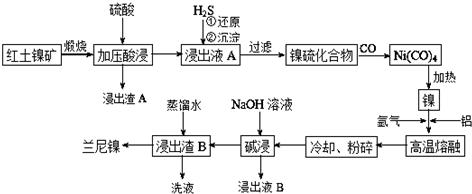
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

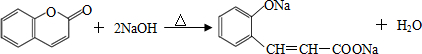 .
. 、
、 、
、 (其中三种).
(其中三种). 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石、碳化硅、晶体硅的熔点依次升高 | |
| B. | CO2和SiO2 化学式相似,物理性质也相似 | |
| C. | CH3CH(CH2OH)CH2OOCCH3是一种手性分子,水解后手性消失 | |
| D. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com