
【题目】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
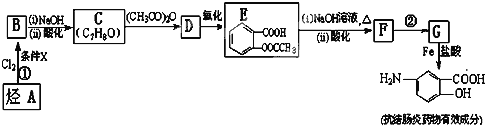
根据以上信息回答下列问题:
(1)C的结构简式是______。
(2)①的反应条件是______,②的反应类型是______。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是:______。
A.水溶性比苯酚好,密度比苯酚的大B.能发生消去反应
C.能发生加聚反应 D.既有酸性又有碱性
(4)E与足量NaOH溶液反应的化学方程式是______。
(5)符合下列条件的E的同分异构体还有______种,写出其中核磁共振氢谱图有四种峰的结构简式______。
a.与E具有相同的官能团且官能团不在同一侧链
b.水解产物之一能与氯化铁发生显色反应
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此写出以A为原料合成化合物![]() 的合成路线______。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线______。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
【答案】![]() Fe或FeCl3作催化剂 取代反应 AD
Fe或FeCl3作催化剂 取代反应 AD 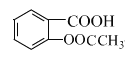 +3NaOH
+3NaOH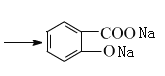 +CH3COONa+2H2O 15
+CH3COONa+2H2O 15 ![]()
![]()
【解析】
C发生信息(a)中的反应生成D,D发生氧化反应生成E,结合C的分子式与E的结构简式,可知C的结构简式为![]() ,则D为
,则D为![]() ,D用酸性高锰酸钾溶液氧化得到E:
,D用酸性高锰酸钾溶液氧化得到E:![]() ;烃A与氯气在FeCl3催化剂条件下反应得到B,B发生水解反应、酸化得到C,则A为
;烃A与氯气在FeCl3催化剂条件下反应得到B,B发生水解反应、酸化得到C,则A为![]() ,B为
,B为![]() ;E与氢氧化钠反应、酸化得到F为
;E与氢氧化钠反应、酸化得到F为![]() ,由信息(b)并结合抗结肠炎药物有效成分的结构可知,F在浓硫酸、浓硝酸加热条件下发生反应生成G为
,由信息(b)并结合抗结肠炎药物有效成分的结构可知,F在浓硫酸、浓硝酸加热条件下发生反应生成G为![]() ,G发生还原反应得到抗结肠炎药物有效成分;
,G发生还原反应得到抗结肠炎药物有效成分;
(6)甲苯和浓硝酸发生取代反应生成邻甲基硝基苯,邻甲基硝基苯和酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸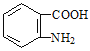 。
。
(1)根据上述分析可知C的结构简式为![]() ;
;
(2)反应①是![]() 在Fe或FeCl3催化作用下发生苯环上的取代反应产生B:
在Fe或FeCl3催化作用下发生苯环上的取代反应产生B:![]() ,所以反应①条件下Fe或FeCl3作催化剂;
,所以反应①条件下Fe或FeCl3作催化剂;
反应②是F:![]() 与浓硝酸、浓硫酸混合加热发生取代反应产生G:
与浓硝酸、浓硫酸混合加热发生取代反应产生G:![]() ,所以该反应类型为取代反应;
,所以该反应类型为取代反应;
(3)A.该物质分子中含有羧基、氨基与水分子之间可以形成氢键,其水溶性比苯酚好,密度比苯酚的大,A正确;
B.不能发生消去反应,B错误;
C.含有羧基、氨基,可以发生缩聚反应,不能发生加聚反应,C错误;
D.含有羧基、氨基,因此该物质既有酸性又有碱性,D正确;
故合理选项是AD;
(4)E是![]() ,E与足量NaOH溶液反应的化学方程式是:
,E与足量NaOH溶液反应的化学方程式是: +3NaOH
+3NaOH +CH3COONa+2H2O;
+CH3COONa+2H2O;
(5)E的同分异构体符合下列条件:
a.与E具有相同的官能团,即含有酯基和羧基,且官能团不在同一侧链;
b.水解产物之一能与氯化铁发生显色反应,即分子中有酚酯基,则符合条件的E的同分异构体为苯环上连有-CH3、-COOH、-OOCH,根据定二动一的原则,共有10种结构,也可以苯环上连有-CH2COOH、-OOCH,或CH3COO-、-COOH,每种都有邻间对三种,除去E自身的结构外还有15种,其中核磁共振氢谱图有四种峰的结构简式为![]() ;
;
(6)甲苯![]() 和浓硝酸发生取代反应生成邻甲基硝基苯
和浓硝酸发生取代反应生成邻甲基硝基苯![]() ,邻甲基硝基苯和酸性高锰酸钾溶液氧化生成邻硝基苯甲酸
,邻甲基硝基苯和酸性高锰酸钾溶液氧化生成邻硝基苯甲酸![]() ,邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸
,邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸![]() ,故其合成路线为
,故其合成路线为![]() 。
。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
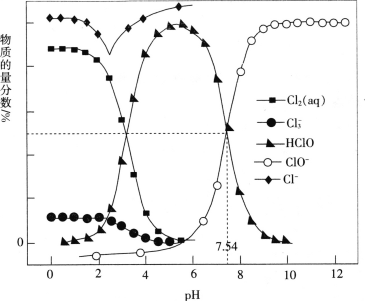
A.pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
B.氯水中的Cl2、ClO-、HClO均能与K2S发生反应
C.已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3- (aq)的K=0.191,当pH增大时,K减小
Cl3- (aq)的K=0.191,当pH增大时,K减小
D.该温度下,HClO![]() H++ClO-的电离常数Ka=10-7.54
H++ClO-的电离常数Ka=10-7.54
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以磷石膏(主要含CaSO4,还含少量SiO2、Fe2O3)为原料制取轻质 CaCO3,其实验流程如下:
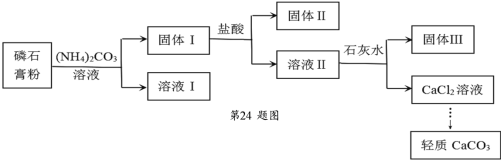
下列说法不正确的是
A.固体Ⅰ、固体Ⅱ中含有 SiO2,固体Ⅲ中含有 Fe(OH)3
B.由固体Ⅰ为原料制备 CaCl2 溶液使用的盐酸和石灰水均要过量
C.加入(NH4)2CO3 溶液的离子方程式为:CaSO4+CO32ˉ=CaCO3+SO42ˉ
D.检验固体Ⅰ洗涤是否完全,可取最后一次洗涤液往其中滴加盐酸酸化的 BaCl2 溶液,看有无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物 X 由 3 种元素组成。某学习小组进行了如下实验:
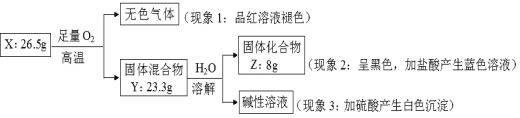
请回答:
(1)由现象 1 得出化合物 X 含有_____________元素(填元素符号),X 的化学式_____________。
(2)固体混合物 Y 的成分_____________ (填化学式)。
(3)实验室常将氨气(NH3)通过红热的黑色固体化合物 Z 制备氮气,该反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.银氨溶液可以用于区分麦芽糖和蔗糖
B.乙醇、乙二醇、丙三醇的沸点依次升高
C.1mol乙酰水杨酸(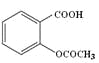 )最多可以和2mol NaOH反应
)最多可以和2mol NaOH反应
D.可用![]() 和HCHO为原料合成
和HCHO为原料合成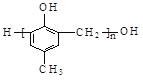
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式_____________。
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用图中的曲线表示是________(填序号).

(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
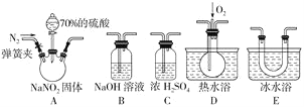
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为·![]() ·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B______,C________,D________。
(2)D元素在周期表中属于第________周期______族。
(3)用电子式表示A的气态氢化物的形成过程:____________。
(4)A和B的单质充分反应生成的化合物的结构式是___________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com