
 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.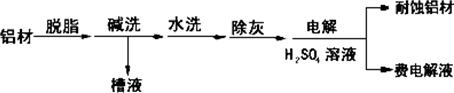
分析 (1)①有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
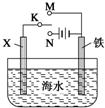
(2)根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法).
解答 解:(1)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO+3H2↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.3HCO3-+Al3+=3CO2↑+Al(OH)3↓;或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;
(2)金属的防护有牺牲阳极保法和外加电源阴极保护法,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法). 故答案为:N;牺牲阳极保护法(或牺牲阳极的阴极保护法).
点评 本题考查混合物分离提纯,为山东高考题,侧重于学生的分析与实验能力的考查,把握流程中的反应及混合物分离方法为解答该类题目的关键,注意水解原理、电化学反应原理的应用,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数:Z>X>W | |
| B. | 单质的沸点:Z>X | |
| C. | 原子的最外层电子数:Y>W>Z | |
| D. | 标准状况下,5.6LW的单质中含有0.5mol原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙有强氧化性,用于饮用水消毒 | |
| B. | 木炭具有还原性,用于制冰箱除味剂 | |
| C. | 氧化铝具有两性,用于工业冶炼铝单质 | |
| D. | 氯化铁溶液呈酸性,用于蚀刻铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇 丙三醇 | B. | C6H5-OH C6H5CH2-OH | ||
| C. | C3H6 和C4H8 | D. | C2H6和C10H22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| B. | 将Na放入水中 2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 氢氧化铝溶于盐酸 OH-+H+=H2O | |
| D. | 小苏打与氢氧化钠反应 HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO2的水解产物是Ca(OH)2和H2O2 | B. | NaClO的水解产物之一是HClO | ||
| C. | PCl3的水解产物是PH3和HClO | D. | Mg3N2水解生成NH3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (2)(6) | B. | (1)(2)(3)(6) | C. | (3) | D. | (2)(4)(6) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com